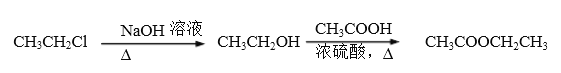题目内容
【题目】某化学兴趣小组用如图装置电解CuSO4溶液,测定铜的相对原子质量.

(1)若实验中测定在标准状况下放出的氧气的体积VL,B连接直流电源的__ (填“正极”或“负极”),并写出B极发生反应的电极反应式__.
(2)电解开始一段时间后,在U形管中可观察到的现象__.并写出该电解反应总的离子方程式__.
(3)实验中还需测定的数据是__(填写序号).
①A极的质量增重mg ②B极的质量增重mg
(4)铜的相对原子质量为:__(用含有m、V的计算式表示).
(5)如果用碱性(KOH为电解质)甲烷燃料电池作为电源进行实验,放电时负极的电极反应式为__.
【答案】 正极 4OH﹣﹣4e﹣=O2↑+2H2O 铜电极上有红色固体析出,石墨电极上有无色气体产生,溶液蓝色变浅 2Cu2++2H2O![]() 2Cu+O2↑+4H+ ①
2Cu+O2↑+4H+ ① ![]() CH4+10OH﹣﹣8e﹣═CO32﹣+7H2O
CH4+10OH﹣﹣8e﹣═CO32﹣+7H2O
【解析】(1).若实验中测定在标准状况下放出的氧气的体积为VL,说明阳极上是氢氧根离子放电而不是铜放电,所以铜作阴极,石墨作阳极,则A连接直流电源的负极,B连接直流电源的正极,B是阳极,发生反应:4OH--4e-=O2↑+2H2O,故答案为:正极;4OH--4e-=O2↑+2H2O;
(2).电解硫酸铜溶液时,石墨作阳极,则阴极上铜离子得电子而析出铜,阳极上氢氧根离子放电而生成氧气,溶液中铜离子浓度减小,溶液颜色变浅,电池反应式为:2Cu2++2H2O![]() 2Cu+O2↑+4H+,故答案为:铜电极上有红色固体析出,石墨电极上有无色气体产生,溶液蓝色变浅;2Cu2++2H2O
2Cu+O2↑+4H+,故答案为:铜电极上有红色固体析出,石墨电极上有无色气体产生,溶液蓝色变浅;2Cu2++2H2O![]() 2Cu+O2↑+4H+;
2Cu+O2↑+4H+;
(3).要测定铜的相对原子质量还要测定析出铜的质量,A电极上析出铜,故选①;
(4).根据2Cu2++2H2O![]() 2Cu+O2↑+4H+可知,标准状况下,生成22.4L氧气时析出2mol铜,析出mg铜时放出VL氧气,则铜的相对原子质量=
2Cu+O2↑+4H+可知,标准状况下,生成22.4L氧气时析出2mol铜,析出mg铜时放出VL氧气,则铜的相对原子质量=![]() =
=![]() ,故答案为:
,故答案为: ![]() ;
;
(5).如果用碱性(KOH为电解质)甲烷燃料电池作为电源进行实验,在甲烷燃料电池中,负极上甲烷失电子发生氧化反应,电极反应式为:CH4+10OH--8e-═CO32-+7H2O,故答案为:CH4+10OH--8e-═CO32-+7H2O。

【题目】下图为元素周期表的一部分,根据元素①~⑧在周期表中的位置,按要求回答下列问题。
族 周期 | IA | 0 | ||||||
1 | ① | IIA | IIIA | ⅣA | VA | ⅥA | VIIA | |
2 | ② | ③ | ||||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
(1)在元素①~⑧中,金属性最强的元素是_____________(填元素符号),最不容易形成化合物的元素是______________(填元素符号)。
(2)用电子式表示⑦的气态氢化物的形成过程________________________。
(3)③、④、⑥中原子半径由大到小的顺序是____________________(填元素符号)。
【题目】有机化合物J是治疗心脏病药物的一种中间体,分子结构中含有3个六元环。其中一种合成路线如下:
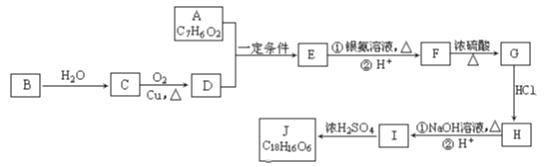
已知:①有关A的信息如下:
能发生银镜反应 |
与FeCl3溶液发生显色反应 |
核磁共振氢谱显示有4组峰,峰面积之比为1∶2∶2∶1 |
②有机物B是一种重要的石油化工产品,其产量可用来衡量国家的石油化工发展水平。
③![]()
回答以下问题:
(1)A中含有的含氧官能团名称是____和____。
(2)B→C的反应条件是:____。
(3)写出反应类型: G→H:_______、I→J:___。
(4)写出F生成G的化学方程式_______。
(5)写出J的结构简式 _____。
(6)结合题给信息,以D为原料经过三步反应制备1,3-丁二烯,设计合成路线(其他试剂任选)。
合成路线流程图示例:___________________