题目内容
18.在含有NaCl、KCl、Na2SO4、K2SO4四种物质的混合溶液中,已知Na+、Cl-和K+的物质的量浓度分别为0.8mol/L、0.7mol/L和0.4mol/L,则SO42-的物质的量浓度是( )| A. | 0.50 mol/L | B. | 0.40 mol/L | C. | 0.30 mol/L | D. | 0.25 mol/L |
分析 任何电解质溶液中都存在电荷守恒,根据电荷守恒计算硫酸根离子浓度.
解答 解:任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(SO42-)=$\frac{c(N{a}^{+})+c({K}^{+})-c(C{l}^{-})}{2}$=$\frac{0.8+0.4-0.7}{2}$mol/L=0.25 mol/L,故选D.
点评 本题考查物质的量浓度有关计算,为高频考点,明确电解质溶液中存在的电荷守恒是解本题关键,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
8.从下列事实所列出的相应结论正确的是( )
| 实验事实 | 结论 | |
| ① | 铜生的锈是绿色的称为铜绿 | 铜绿是致密的氧化膜 |
| ② | 浓硫酸可除去烧瓶内残留的MnO2,稀硝酸可除去试管内壁的银镜,用磨口玻璃瓶保存NaOH溶液 | 都发生了氧化还原反应 |
| ③ | 少量CO2通入Na[Al(OH)4]溶液产生白色沉淀和Na2CO3 | 酸性:HCO3->Al(OH)3 |
| ④ | 某溶液加入稀盐酸产生能使澄清石灰水变浑浊的无色无味气体,该溶液滴加CaCl2溶液,有白色沉淀现象 | 确定该溶液存在CO${\;}_{3}^{2-}$ |
| ⑤ | 某无色溶液中加入浓氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝 | 该溶液一定有NH${\;}_{4}^{-}$ |
| A. | ②③⑤ | B. | ①②③ | C. | ③④⑤ | D. | 全部 |
9.下列物质既能使酸性高锰酸钾溶液褪色,又能使溴水褪色的是( )
| A. | 乙酸乙酯 | B. | 甲烷 | C. | 乙酸 | D. | 植物油 |
6.化工行业的发展必须符合国家节能减排的总体要求.请回答下列问题:
(1)已知C(s)+H2O(g)?CO(g)+H2(g),则该反应的平衡常数表达式为$\frac{{C({H_2})C(CO)}}{{C({H_2}O)}}$.
(2)已知在一定温度下,
C(s)+CO2(g)?2CO(g)△H1
CO(g)+H2O(g)?H2(g)+CO2(g)△H2
C(s)+H2O(g)?CO(g)+H2(g)△H3
则△H1、△H2、△H3之间的关系是:△H1+△H2=△H3.
(3)通过研究不同温度下平衡常数可以解决某些实际问题.已知等体积的一氧化碳和水蒸气进入反应时,会发生如下反应:CO(g)+H2O(g)?H2(g)+CO2(g),该反应平衡常数随温度的变化如表所示.
则该反应的正反应方向是放热反应(填“吸热”或“放热”),在500℃时,若设起始时CO和H2O的起始浓度均为0.020mol/L,则CO的平衡转化率为75%.
(4)从氨催化氧化可以制硝酸,此过程中涉及氮氧化物,如NO、NO2、N2O4等.对反应N2O4(g)?2NO2(g)△H>0在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的是D:
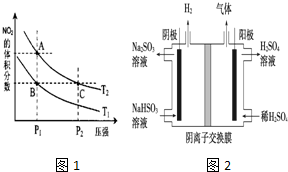
A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.B、C两点的气体的平均相对分子质量:B<C
D.由状态A到状态B,可以用加热的方法
E.A、C两点的化学平衡常数:A=C
(5)工业上用Na2SO3吸收尾气中的SO2,再用右图装置电解(惰性电极)NaHSO3制取H2SO4(阴离子交换膜只永许阴离子通过),阳极电极反应式为:4OH--4e-=2H2O+O2↑.
(1)已知C(s)+H2O(g)?CO(g)+H2(g),则该反应的平衡常数表达式为$\frac{{C({H_2})C(CO)}}{{C({H_2}O)}}$.
(2)已知在一定温度下,
C(s)+CO2(g)?2CO(g)△H1
CO(g)+H2O(g)?H2(g)+CO2(g)△H2
C(s)+H2O(g)?CO(g)+H2(g)△H3
则△H1、△H2、△H3之间的关系是:△H1+△H2=△H3.
| 温度/℃ | 400 | 500 | 800 |
| 平衡常数K | 9.94 | 9 | 1 |
则该反应的正反应方向是放热反应(填“吸热”或“放热”),在500℃时,若设起始时CO和H2O的起始浓度均为0.020mol/L,则CO的平衡转化率为75%.
(4)从氨催化氧化可以制硝酸,此过程中涉及氮氧化物,如NO、NO2、N2O4等.对反应N2O4(g)?2NO2(g)△H>0在温度为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如图所示.下列说法正确的是D:

A.A、C两点的反应速率:A>C
B.A、C两点气体的颜色:A深,C浅
C.B、C两点的气体的平均相对分子质量:B<C
D.由状态A到状态B,可以用加热的方法
E.A、C两点的化学平衡常数:A=C
(5)工业上用Na2SO3吸收尾气中的SO2,再用右图装置电解(惰性电极)NaHSO3制取H2SO4(阴离子交换膜只永许阴离子通过),阳极电极反应式为:4OH--4e-=2H2O+O2↑.
3.下列关于苯乙烯(结构简式为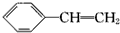 )可以发生的反应是( )
)可以发生的反应是( )
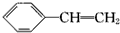 )可以发生的反应是( )
)可以发生的反应是( )| A. | 氧化反应 | B. | 加成反应 | ||
| C. | 能与酸性重铬酸钾反应 | D. | 加聚反应 | ||
| E. | 能使溴水褪色 |
10.某无色溶液中加入过量的稀盐酸有沉淀生成,过滤后向碱溶液中加入过量的纯碱溶液又有沉淀生成,下列溶液中符合此条件的是( )
①Ag+、Fe3+、Na+
②Ag+、Al3+、K+
③Ag+、Ba2+、NO${\;}_{3}^{-}$
④SiO${\;}_{3}^{2-}$、AlO${\;}_{2}^{2-}$、K+
⑤Ag+、NH${\;}_{4}^{+}$、H+
⑥AlO2-、K+、Al3+.
①Ag+、Fe3+、Na+
②Ag+、Al3+、K+
③Ag+、Ba2+、NO${\;}_{3}^{-}$
④SiO${\;}_{3}^{2-}$、AlO${\;}_{2}^{2-}$、K+
⑤Ag+、NH${\;}_{4}^{+}$、H+
⑥AlO2-、K+、Al3+.
| A. | ①②⑤ | B. | ②③④ | C. | ②③④⑥ | D. | ①②③④⑥ |
8.为了比较铁和铜金属活动性强弱,某研究小组的同学设计了如下一些方案,并将实验结果记录如下:
能根据以上各种现象或产物证明铁的金属活动性比铜强的方案一共有( )
能根据以上各种现象或产物证明铁的金属活动性比铜强的方案一共有( )
| 方案 | 现象或产物 |
| ①将铁片置于CuSO4溶液中 | 铁片上有亮红色物质析出 |
| ②将铁丝和铜丝分别在氯气中燃烧 | 产物分别为FeCl3和CuCl2 |
| ③将铁片和铜片分别放入热浓硫酸中 | 产物分别为Fe2(SO4)3和CuSO4 |
| ④将铁片和铜片分别置于稀硫酸溶液中 | 铁片上有气泡,铜片上不产生气泡 |
| ⑤将铁片和铜片同时插入盛有稀硫酸的烧杯中,并用导线连接 | 铁片溶解,铜片上有气泡产生 |
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
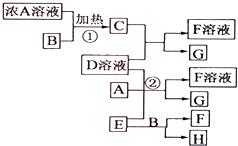 以下均为中学化学常见物质,存在如下转化关系(部分产物已省略).通常C为气体单质,G为紫黑色固体单质.实验室中,常用固体E在B的催化下加热制取气体单质H.
以下均为中学化学常见物质,存在如下转化关系(部分产物已省略).通常C为气体单质,G为紫黑色固体单质.实验室中,常用固体E在B的催化下加热制取气体单质H. ;
;