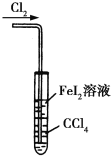
题目内容
【题目】实验室要配制480mL 0.2 mol·L-1 NaCl溶液,实验室只有含有少量硫酸钠的氯化钠样品,设计如下方案,请回答下列问题:
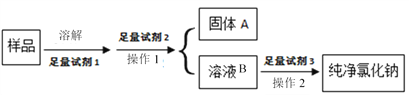
Ⅰ.粗盐提纯
(1)固体A的成分为________________(填化学式)。
(2)试剂2的化学式为_____________,判断试剂2是否过量的方法_______________,操作2的名称__________________。
Ⅱ.配制溶液
(1)用托盘天平称取氯化钠,其质量为________g。
(2)配制过程中需要使用的实验仪器除了托盘天平、药匙、量筒、玻璃棒、烧杯、胶头滴管外,还需要___________。
(3)下列主要操作步骤的正确顺序是①—____—_____— ____—④(填序号)。
①称取一定质量的氯化钠,放入烧杯中,用适量蒸馏水溶解
②加水至液面离容量瓶颈刻度线下1~2厘米时,改用胶头滴管滴加蒸馏水至凹液面与刻度线相切
③将溶液转移到容量瓶中
④盖好瓶塞,反复上下颠倒,摇匀
⑤用少量的蒸馏水洗涤烧杯内壁和玻璃棒2~3次,洗涤液转移到容量瓶中
(4)下列情况对所配制的NaCl溶液浓度有何影响?(选填“偏大”、“偏小”或“无影响”)
①容量瓶用蒸馏洗涤后残留有少量的水________________;
②定容时,仰视容量瓶的刻度线________________;
③转移溶液时,玻璃棒的下端靠在容量瓶的刻度线以上的内壁________________。
【答案】 BaCO3、BaSO4 Na2CO3 取少量上清液于试管中,滴加BaCl2溶液,若无白色沉淀产生则试剂2未过量 蒸发结晶 5.9 500mL容量瓶 ③ ⑤ ② 无影响 偏小 偏小
【解析】Ⅰ、粗盐中含与硫酸钠,除去硫酸根离子应选择试剂1氯化钡溶液,氯化钡与硫酸钠反应生成硫酸钡沉淀和氯化钠,然后在用试剂2碳酸钠溶液除去过量的氯化钡,过滤得到的溶液中含有碳酸钠和氯化钠,加入足量的试剂3盐酸,盐酸与碳酸钠反应生成氯化钠和二氧化碳和水,可以除去过量的碳酸根离子,最后经过蒸发结晶得到纯净的氯化钠;
(1)根据以上分析可知固体A的化学式为:BaSO4、BaCO3(2)试剂2为碳酸钠;检验试剂2碳酸钠是否过量只需要检验溶液中是否含有碳酸根离子存在即可,操作为:取少量上清液于试管中,滴加BaCl2溶液,若无白色沉淀产生则试剂2未过量;从氯化钠溶液中得到氯化钠固体的操作为蒸发结晶;
Ⅱ、(1)配制480mL 0.2mol/L NaCl溶液,应选择500mL容量瓶,实际配制500mL溶液,需要溶质的质量m=0.2mol/L×0.5L×58.5g/mol=5.85g≈5.9g;(2)配制一定物质的量浓度溶液的一般步骤:计算、称量、溶解、移液、洗涤、定容等,用到的仪器:托盘天平、药匙、烧杯、玻璃棒、容量瓶、胶头滴管等,因此还需要500mL容量瓶;(3)配制一定物质的量浓度溶液的一般步骤:金属、称量、溶解、移液、洗涤、定容等,所以正确的顺序为:①③⑤②④;(4)①容量瓶用蒸馏洗涤后残留有少量的水不会影响;②定容时,仰视容量瓶的刻度线,液面超过刻度线,浓度偏低;③转移溶液时,玻璃棒的下端靠在容量瓶的刻度线以上的内壁,溶液体积增加,浓度偏低。

【题目】某化学兴趣小组利用下图装置进行乙酸乙酯合成和分离的实验探究,请回答以下问题
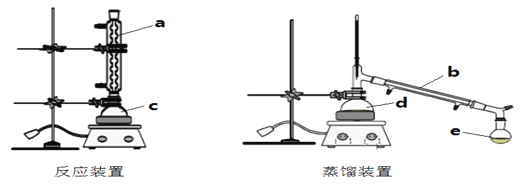
(1)写出合成乙酸乙酯的化学方程式_______________________________。
(2)仪器b的名称________,图中起冷凝回流作用的是______(填a、b、c、d、e)。
(3)为了提高乙酸乙酯的产率可采取的措施 _______________________________
(4)经过0.5h加热反应后,将反应装置c中粗产品转移至d中进行蒸馏。
物质 | 98.3%浓硫酸 | 乙酸乙酯 | 乙酸 | 乙醇 | 乙醚 | 水 |
沸点 | 338℃, | 77.1℃ | 118℃ | 78.5℃ | 34.6℃ | 100℃ |
根据上表分析,蒸馏后得到的乙酸乙酯中,最有可能含有________________杂质。