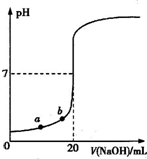
题目内容
反应4NH3(g)+5O2(g)=4NO(g)+6H2O(g)在2L密闭容器中进行1分钟后,NH3减少了0.12mol,则平均每秒钟浓度变化正确的是( )
| A.NO:0.001mol?L-1 | B.H2O:0.002mol?L-1 |
| C.NH3:0.002mol?L-1 | D.O2:0.0025mol?L-1 |
由1分钟后,NH3减少了0.12mol,则用NH3表示的化学反应速率为V(NH3)=V=
=
=
=0.001mol?(L?s)-1,
A、由化学反应速率之比等于化学计量数之比,则v(NO)=v(NH3)=0.001 mol?(L?s)-1,所以NO平均每秒钟浓度变化为0.001 mol/L,故A正确;
B、由化学反应速率之比等于化学计量数之比,则v(H2O)=
v(NH3)=0.0015 mol?(L?s)-1,所以NO平均每秒钟浓度变化为0.0015mol/L,故B错误;
C、因V(NH3)=0.001mol?(L?s)-1,所以NH3平均每秒钟浓度变化为0.001mol/L,故C错误;
D、由化学反应速率之比等于化学计量数之比,则v(O2)=
v(NH3)═0.00125 mol?(L?s)-1,所以O2平均每秒钟浓度变化为0.00125mol/L,故D错误;
故选:A.
| △c |
| △t |
| ||
| △t |
| ||
| 60s |
A、由化学反应速率之比等于化学计量数之比,则v(NO)=v(NH3)=0.001 mol?(L?s)-1,所以NO平均每秒钟浓度变化为0.001 mol/L,故A正确;
B、由化学反应速率之比等于化学计量数之比,则v(H2O)=
| 6 |
| 4 |
C、因V(NH3)=0.001mol?(L?s)-1,所以NH3平均每秒钟浓度变化为0.001mol/L,故C错误;
D、由化学反应速率之比等于化学计量数之比,则v(O2)=
| 5 |
| 4 |
故选:A.

练习册系列答案
相关题目
 K(g)+NaCl(l)
K(g)+NaCl(l)  (m-x)CeO2
(m-x)CeO2 xCe+xO2
xCe+xO2 mCeO2+xH2+xCO
mCeO2+xH2+xCO HCO3-+OH-的平衡常熟Kh= 。
HCO3-+OH-的平衡常熟Kh= 。