题目内容
【题目】根据要求填空(所涉及元素均为前20号)
(1)A元素的原子M层有5个电子,则其原子结构示意图为__________________;最高价氯化物的化学式_______________________。
(2)C元素原子最外层电子是最内层电子的3倍,其形成的离子与Ar元素有相同的电子结构,请写出C离子的结构示意图和电子式:________________、_________。
(3)标出下列反应的电子转移方向和数目,并填写有关内容:
KClO3+6HCl→3Cl2↑+3H2O+KCl、___________
氧化剂______________;氧化产物______________;还原剂______________;还原产物______________;被氧化的元素______________;HCl的作用______________.
【答案】 PCl5
PCl5 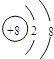
![]()
 KClO3 Cl2 HCl Cl2 Cl 酸性的作用和还原剂
KClO3 Cl2 HCl Cl2 Cl 酸性的作用和还原剂
【解析】
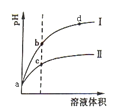
(1)A元素的原子M层有5个电子,则第三层电子层上有5个电子,所以第一和第二层已经排满,为磷元素,其原子结构示意图为 ;最高正化合价为+5价,其最高价氯化物的化学式为PCl5;
;最高正化合价为+5价,其最高价氯化物的化学式为PCl5;
(2)C元素原子最外层电子是最内层电子的3倍,其形成的离子与Ar元素有相同的电子结构,则含有两个电子层,各层电子数分别为2、6,为O元素,O2-的结构示意图为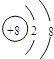 ,电子式为
,电子式为![]() ;
;
(3)KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O的反应中,KClO3中Cl元素的化合价由+5价降低为0,氧化剂是KClO3,被还原,还原产物为Cl2,还原剂是HCl,被氧化,氧化产物为Cl2;被氧化的元素为Cl;HCl的作用为酸性的作用和还原剂;双线桥法表示氧化还原反应为 。
。

 学习实践园地系列答案
学习实践园地系列答案【题目】已知:Fe2+遇铁氰化钾(K3[Fe(CN)6])会产生特征的蓝色沉淀;AgI是难溶于水的黄色固体。将0.2mol·L-1的KI溶液和0.05mol·L-1Fe2(SO4)3溶液等体积混合后,取混合液分别完成上述实验,能说明溶液中存在化学平衡“2Fe3++2I-![]() 2Fe2++I2”的是( )
2Fe2++I2”的是( )
编号 | 实验操作 | 实验现象 |
① | 滴入KSCN溶液 | 溶液变红色 |
② | 滴入AgNO3溶液 | 生成黄色沉淀 |
③ | 滴入K3[Fe(CN)6]溶液 | 生成蓝色沉淀 |
④ | 滴入淀粉溶液 | 溶液变蓝色 |
A.①B.②和④C.③和④D.③