题目内容
已知某溶液中只存在OH-、H+、NH4+、Cl-四种离子,某同学推测其离子浓度大小顺序可能有如下四种关系:
①c(Cl-)>c(NH4+)>c(H+)>c(OH-)
②c(NH4+)>c(OH-)>c(Cl-)>c(H+)
③c(NH4+)>c(Cl-)>c(OH-)>c(H+)
④c(Cl-)>c(H+)>c(NH4+)>c(OH-)
填写下列空白
(1)若溶液中只溶解一种溶质,则该溶质是
(2)若四种离子的关系符合③,则溶质为
(3)将pH相同的NH4Cl溶液和HCl溶液稀释相同的倍数,下列图象正确的是(填图象符号)

(4)若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)
①c(Cl-)>c(NH4+)>c(H+)>c(OH-)
②c(NH4+)>c(OH-)>c(Cl-)>c(H+)
③c(NH4+)>c(Cl-)>c(OH-)>c(H+)
④c(Cl-)>c(H+)>c(NH4+)>c(OH-)
填写下列空白
(1)若溶液中只溶解一种溶质,则该溶质是
NH4Cl
NH4Cl
(填化学式),上述四种离子浓度的大小顺序为(填序号)①
①
,用离子方程式表示呈现该顺序的原因NH4++H2O?NH3.H2O+H+
NH4++H2O?NH3.H2O+H+
.(2)若四种离子的关系符合③,则溶质为
NH4Cl、NH3.H2O
NH4Cl、NH3.H2O
(填化学式);若四种离子的关系符合④,则溶质为HCl、NH4Cl
HCl、NH4Cl
(填化学式);(3)将pH相同的NH4Cl溶液和HCl溶液稀释相同的倍数,下列图象正确的是(填图象符号)
B
B
;
(4)若该溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)
<
<
c(NH3?H2O)(填“>”“<”或“=”).分析:(1)任何水溶液中都有OH-、H+,若溶质只有一种则为NH4Cl,利用铵根离子水解使溶液显酸性来分析;
(2)由③中离子的关系可知溶液显碱性,且c(NH4+)>c(Cl-),则溶液为氯化铵和氨水的混合溶液;由④中的离子关系可知溶液显酸性,且c(Cl-)>c(H+)>c(NH4+),则溶液为盐酸与氯化铵的混合溶液;
(3)pH相同的NH4Cl溶液和HCl溶液稀释相同的倍数,盐酸为强电解质,则pH变化程度大,而稀释时促进氯化铵中铵根离子水解,则pH变化小;
(4)体积相等稀盐酸和氨水混合,若浓度相等,则恰好完全反应生成氯化铵,溶液显酸性,则溶液恰好呈中性时应为氨水与氯化铵的混合溶液来分析.
(2)由③中离子的关系可知溶液显碱性,且c(NH4+)>c(Cl-),则溶液为氯化铵和氨水的混合溶液;由④中的离子关系可知溶液显酸性,且c(Cl-)>c(H+)>c(NH4+),则溶液为盐酸与氯化铵的混合溶液;
(3)pH相同的NH4Cl溶液和HCl溶液稀释相同的倍数,盐酸为强电解质,则pH变化程度大,而稀释时促进氯化铵中铵根离子水解,则pH变化小;
(4)体积相等稀盐酸和氨水混合,若浓度相等,则恰好完全反应生成氯化铵,溶液显酸性,则溶液恰好呈中性时应为氨水与氯化铵的混合溶液来分析.
解答:解:(1)因任何水溶液中都有OH-、H+,若溶质只有一种则为NH4Cl,铵根离子水解方程式为NH4++H2O?NH3.H2O+H+,则c(Cl-)>c(NH4+),水解显酸性,则c(H+)>c(OH-),又水解的程度很弱,则c(Cl-)>c(NH4+)>c(H+)>c(OH-),即①符合,故答案为:NH4Cl;①;NH4++H2O?NH3.H2O+H+;
(2)③中离子的关系可知溶液显碱性,且c(NH4+)>c(Cl-),则溶液为氯化铵和氨水的混合溶液,其溶质为NH4Cl、NH3.H2O;④中的离子关系可知溶液显酸性,且c(Cl-)>c(H+)>c(NH4+),则溶液为盐酸与氯化铵的混合溶液,其溶质为HCl、NH4Cl,故答案为:NH4Cl、NH3.H2O;HCl、NH4Cl;
(3)pH相同的NH4Cl溶液和HCl溶液稀释时氢离子的浓度都变小,则pH都变大,但盐酸为强电解质,则pH变化程度大,而氯化铵水解显酸性,稀释促进水解,氢离子浓度减小的倍数小于盐酸中氢离子浓度的变化,则pH变化小,只有B符合题意,故答案为:B;
(4)因体积、浓度相同的稀盐酸和氨水混合,溶液中的溶质为氯化铵,液显酸性,而该溶液恰好呈中性,故应为氨水与氯化铵的混合溶液,即c(HCl)<c(NH3?H2O),故答案为:<.
(2)③中离子的关系可知溶液显碱性,且c(NH4+)>c(Cl-),则溶液为氯化铵和氨水的混合溶液,其溶质为NH4Cl、NH3.H2O;④中的离子关系可知溶液显酸性,且c(Cl-)>c(H+)>c(NH4+),则溶液为盐酸与氯化铵的混合溶液,其溶质为HCl、NH4Cl,故答案为:NH4Cl、NH3.H2O;HCl、NH4Cl;
(3)pH相同的NH4Cl溶液和HCl溶液稀释时氢离子的浓度都变小,则pH都变大,但盐酸为强电解质,则pH变化程度大,而氯化铵水解显酸性,稀释促进水解,氢离子浓度减小的倍数小于盐酸中氢离子浓度的变化,则pH变化小,只有B符合题意,故答案为:B;
(4)因体积、浓度相同的稀盐酸和氨水混合,溶液中的溶质为氯化铵,液显酸性,而该溶液恰好呈中性,故应为氨水与氯化铵的混合溶液,即c(HCl)<c(NH3?H2O),故答案为:<.
点评:本题较难,考查学生利用离子的关系来分析溶液中的溶质,明确溶液中的电离和水解是解答本题的关键,并注意(3)是学生解答的难点,与强酸、弱酸的稀释相似.

练习册系列答案
 同步奥数系列答案
同步奥数系列答案
相关题目
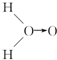 (式中O→O表示配位键,在化学反应中O→O键遇到还原剂时易断裂)
(式中O→O表示配位键,在化学反应中O→O键遇到还原剂时易断裂)
 的沸点高于
的沸点高于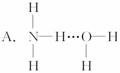

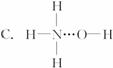

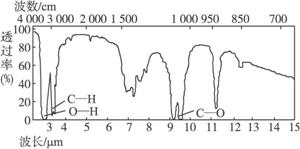


 子反应式: 。
子反应式: 。