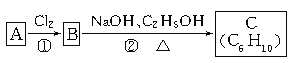题目内容
【题目】以废旧铅蓄电池的含铅废料(主要含Pb、PbO、PbO2、PbSO4)和稀H2SO4为原料制备高纯PbO,实现铅的再生利用。其主要流程如下:
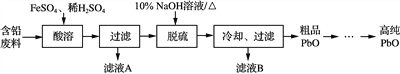
(1) 酸溶过程中加热的目的是______________。酸溶时,在Fe2+催化下,Pb和PbO2反应生成PbSO4的化学方程式是________________________。
(2) 检验滤液A中是否含有Fe2+,可选用下列________试剂(选填序号)。
a. KSCN溶液 b. 氯水 c. 酸性KMnO4溶液
(3) 写出脱硫过程发生主要反应的离子方程式__________________。
(4) 冷却过滤后对所得的固体进行洗涤的操作________________。
(5) PbO溶解在NaOH溶液中,存在平衡:PbO(s)+NaOH(aq)![]() NaHPbO2(aq)
NaHPbO2(aq)
其溶解度曲线如图所示。结合上述溶解度曲线,简述由粗品PbO得到高纯PbO的操作____________。

【答案】 加快酸溶速率 Pb+PbO2+2H2SO4=2PbSO4+2H2O c PbSO4+2OH-=PbO+SO42-+H2O 沿玻璃棒向过滤器(漏斗)中加入蒸馏水至浸没沉淀,待水慢慢流出,重复2~3次 将粗PbO溶解在一定量35% NaOH溶液中,加热至110℃,充分溶解后,趁热过滤,冷却结晶,过滤、洗涤并干燥得到高纯PbO固体
【解析】(1)酸溶过程中加热的目的是加快酸溶速率。酸溶时,在Fe2+催化下,Pb和PbO2反应生成PbSO4的化学方程式是Pb+PbO2+2H2SO4=2PbSO4+2H2O。(2)亚铁离子具有还原性,检验滤液A中是否含有Fe2+,可选用酸性KMnO4溶液,答案选c;(3)脱硫过程中硫酸铅和氢氧化钠溶液反应,因此发生主要反应的离子方程式为PbSO4+2OH-=PbO+SO42-+H2O。(4)洗涤沉淀在过滤器中进行,实验操作是沿玻璃棒向过滤器(漏斗)中加入蒸馏水至浸没沉淀,待水慢慢流出,重复2~3次。(5) 根据图像可知35% NaOH溶液的溶解度受温度影响较大,超过110℃随温度升高而降低,因此由粗品PbO得到高纯PbO的操作为将粗PbO溶解在一定量35% NaOH溶液中,加热至110℃,充分溶解后,趁热过滤,冷却结晶,过滤、洗涤并干燥得到高纯PbO固体。