题目内容
已知A、B、C、D、E是核电荷数依次增大的五种短周期主族元素,原子半径按D、E、B、C、A的顺序依次减小,B和E同主族,下列推断不正确的是( )
分析:B、E是同主族元素,表明B、E在不同周期,原子半径E>B,则B在E的上面周期中;
原子半径A<B,同时,原子序数A<B,表明AB不是在同一周期,因为周期中,原子序数越小,半径越大,因而A、B也不在同一周期中,则A应在第一周期,B、E分别在第二、第三周期;
原子半径D>E,核电荷数D<E,根据同周期原子半径的递变规律可知,D、E处于相同周期,则D应处于第三周期;
原子半径B>C,核电荷数B<C,根据同周期原子半径的递变规律可知,B、C在相同周期,以此解答该题.
原子半径A<B,同时,原子序数A<B,表明AB不是在同一周期,因为周期中,原子序数越小,半径越大,因而A、B也不在同一周期中,则A应在第一周期,B、E分别在第二、第三周期;
原子半径D>E,核电荷数D<E,根据同周期原子半径的递变规律可知,D、E处于相同周期,则D应处于第三周期;
原子半径B>C,核电荷数B<C,根据同周期原子半径的递变规律可知,B、C在相同周期,以此解答该题.
解答:解:B、E是同主族元素,表明B、E在不同周期,原子半径E>B,则B在E的上面周期中;
原子半径A<B,同时,原子序数A<B,表明AB不是在同一周期,因为周期中,原子序数越小,半径越大,因而A、B也不在同一周期中,则A应在第一周期,B、E分别在第二、第三周期;
原子半径D>E,核电荷数D<E,根据同周期原子半径的递变规律可知,D、E处于相同周期,则D应处于第三周期;
原子半径B>C,核电荷数B<C,根据同周期原子半径的递变规律可知,B、C在相同周期,则
A.原子半径D>E,核电荷数D<E,根据同周期原子半径的递变规律可知,D、E处于相同周期,则D应处于第三周期,故A错误;
B.由以上推断可知,A应在第一周期,B在第二周期,D在第三周期,故B正确;
C.若D为第三周期的Na,A为H,则A、D在同一主族,故C正确;
D.由于C为非金属,D为金属(可能),则C、D的单质有可能形成离子化合物,故D正确.
故选A.
原子半径A<B,同时,原子序数A<B,表明AB不是在同一周期,因为周期中,原子序数越小,半径越大,因而A、B也不在同一周期中,则A应在第一周期,B、E分别在第二、第三周期;
原子半径D>E,核电荷数D<E,根据同周期原子半径的递变规律可知,D、E处于相同周期,则D应处于第三周期;
原子半径B>C,核电荷数B<C,根据同周期原子半径的递变规律可知,B、C在相同周期,则
A.原子半径D>E,核电荷数D<E,根据同周期原子半径的递变规律可知,D、E处于相同周期,则D应处于第三周期,故A错误;
B.由以上推断可知,A应在第一周期,B在第二周期,D在第三周期,故B正确;
C.若D为第三周期的Na,A为H,则A、D在同一主族,故C正确;
D.由于C为非金属,D为金属(可能),则C、D的单质有可能形成离子化合物,故D正确.
故选A.
点评:本题考查元素的位置结构性质的相关关系及应用,题目难度较大,本题侧重于原子序数与原子半径的大小关系为考查点,把握元素周期律的递变规律是解答该题的有力保证.

练习册系列答案
 天天向上口算本系列答案
天天向上口算本系列答案
相关题目
已知A、B、C、D分别是Cu、Ag、Fe、Al四种金属中的一种.已知①A、C均能与稀硫酸反应放出气体;②B与D的硝酸盐反应,置换出单质D;③C与强碱反应放出气体,由此可以推断A、B、C、D依次是( )
| A、Fe、Cu、Al、Ag | B、Al、Cu、Fe、Ag | C、Cu、Ag、Al、Fe | D、Ag、Al、Cu、Fe |

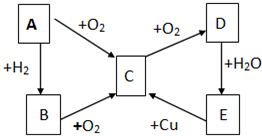 已知A、B、C、D、E五种物质有如图所示的转化关系(部分反应物及反应条件未列出,若解题时需要,可作合理假设),且五种物质中均含有A元素.
已知A、B、C、D、E五种物质有如图所示的转化关系(部分反应物及反应条件未列出,若解题时需要,可作合理假设),且五种物质中均含有A元素. (Ⅰ)通常情况下,微粒A和B为分子,C和E为阳离子,D为阴离子,它们都含有10个电子;B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀.请回答:
(Ⅰ)通常情况下,微粒A和B为分子,C和E为阳离子,D为阴离子,它们都含有10个电子;B溶于A后所得的物质可电离出C和D;A、B、E三种微粒反应后可得C和一种白色沉淀.请回答: