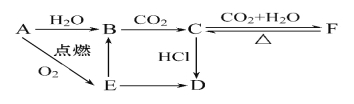
题目内容
【题目】ClO2气体是一种常用的消毒剂,我国从2 000年起逐步用ClO2代替氯气对饮用水进行消毒。
(1)消毒水时,ClO2还可将水中的Fe2+、Mn2+等转化成Fe(OH)3和MnO2等难溶物除去,在这个过程中,Fe2+、Mn2+的化合价升高,说明ClO2具有__________性。
(2)工业上可以通过下列方法制取ClO2,请完成该化学反应方程式:
2KClO3+SO2=2ClO2+__________。
(3)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,是放热反应,当1 mol Cl2参与反应时 释放145 kJ的热量,写出这个反应的热化学方程式:________________。
(4)自来水厂用ClO2处理后的水中,要求ClO2的浓度在0.1~0.8 mg·L-1之间。碘量法可以检 测水中ClO2的浓度,步骤如下:
Ⅰ.取一定体积的水样,加入一定量的碘化钾,再用氢氧化钠溶液调至中性,并加入淀粉溶液,溶液变蓝。
Ⅱ.加入一定量的Na2S2O3溶液。(已知:2S2O![]() +I2=S4O
+I2=S4O![]() +2I-)
+2I-)
Ⅲ.加硫酸调节水样pH至1~3。
操作时,不同pH环境中粒子种类如下图所示:

请回答:
①操作Ⅰ中反应的离子方程式是___________________。
②确定操作Ⅱ完全反应的现象是___________________。
③在操作Ⅲ过程中,溶液又呈蓝色,反应的离子方程式是___________________。
④若水样的体积为1.0L,在操作Ⅱ时消耗了1.0×10-3mol·L-1的Na2S2O3溶液10mL,则水样中ClO2的浓度是________mg·L-1。
【答案】(1)氧化 (2)K2SO4
(3)2Cl2(g)+2H2O(g)+C(s)=4HCl(g)+CO2(g) ΔH=-290 kJ·mol-1
①2ClO2+2I-=2ClO2-+I2
②蓝色消失,且半分钟内不变色
③ClO2-+4I-+4H+=Cl-+2I2+2H2O④0.675
【解析】
试题分析:(1)Fe2+、Mn2+化合价都升高,说明ClO2作氧化剂;
(2)ClO3-中Cl的化合价由+5价→+4价,化合价降低,则SO2中S的化合价应升高,即转化成+6价,根据原子守恒,则应为K2SO4;
(3)①因为淀粉变蓝,说明有I2生成,根据不同pH的环境中粒子种类图,中性溶液Cl以ClO2-存在,ClO2+I-→I2+ClO2-,根据化合价升降法配平,即2ClO2+2I-=2ClO2-+I2;
②操作II是滴定实验,滴定到终点的现象是蓝色消失,且半分钟不变色;
③III中pH调节至1~3时,Cl以Cl-形式存在,溶液又变蓝,说明生成I2,ClO2-作氧化剂,因此有ClO2-+I-→Cl-+I2,根据化合价升降法配平,ClO2-+4I-→Cl-+2I2,因为溶液显酸性,H+作反应物参加反应,因此有ClO2-+4I-+4H+=Cl-+2I2+2H2O;
④根据离子反应方程式为:2ClO2~I2~2S2O32-,因此有n(ClO2)=n(S2O32-)=10×10-3×1.0×10-3×67.5mol,即浓度为10×10-3×1.0×10-3×67.5×103/1mg·L-1=0.675 mg·L-1。

 出彩同步大试卷系列答案
出彩同步大试卷系列答案