题目内容
【题目】广东省有着丰富的海洋资源。海水提取食盐和Br2以后的盐卤可以用来制备纯净的MgCl2或MgO。盐卤中含有Mg2+、Cl-,还含有少量Na+、Fe2+、Fe3+和CO(NH2)2等.制备流程如图所示:
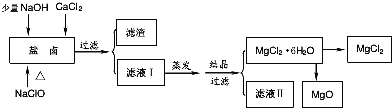
(1)滤渣的成分是____________(填化学式);滤液Ⅱ中所含的主要杂质离子是________(写离子符号)。
(2)用NaClO除去尿素CO(NH2)2时,生成物除盐外,都是能参与大气循环的物质,则该反应的化学方程式为_____________________;
(3)用MgCl26H2O制备无水MgCl2过程中,所需要的化学试剂是___________________;
(4)海水制溴过程中吸收潮湿空气中的Br2是利用SO2气体,SO2吸收Br2的离子方程式是_______________;SO2气体可来源于硫酸工业的尾气,同时,SO2尾气也可用氨水吸收,作为制备化肥的原料,SO2气体用氨水吸收得到的产物可能是___________________________。
【答案】Fe(OH)3 Na+ 3NaClO+CO(NH2)2═3NaCl+CO2↑+N2↑+2H2O或NaOH+3NaClO+CO(NH2)2═3NaCl+NaHCO3+N2↑+2H2O HCl气体 SO2+Br2+2H2O═4H++SO42-+2Br- (NH4)2SO3或NH4HSO3
【解析】
向盐卤溶液中加入NaClO,NaClO具有强氧化性,能将Fe2+氧化为Fe3+,向盐卤中加入少量NaOH,NaOH和Fe3+反应生成Fe(OH)3,CO(NH2)2和NaClO发生氧化还原反应,生成物除盐外,都是能参与大气循环的物质,所以生成物是NaCl、CO2、N2、H2O,过量二氧化碳能和NaOH反应生成碳酸氢钠,将溶液过滤得到的滤渣是Fe(OH)3,滤液I中含有Mg2+、Cl-、Na+,将滤液I蒸发、结晶、过滤得到MgCl26H2O,则滤液中含有的杂质离子是Na+,直接将MgCl26H2O加强热能得到MgO,发生反应MgCl26H2O![]() MgO+2HCl↑+5H2O↑,氯化镁易水解,所以不能用加热MgCl26H2O方法制取氯化镁,要在HCl氛围中制取氯化镁;
MgO+2HCl↑+5H2O↑,氯化镁易水解,所以不能用加热MgCl26H2O方法制取氯化镁,要在HCl氛围中制取氯化镁;
(1)通过以上分析知,滤渣是Fe(OH)3,滤液II中杂质离子是Na+;
(2)通过以上分析知,该反应为3NaClO + CO(NH2)2 ═ 3NaCl + CO2↑ + N2↑ + 2H2O或NaOH + 3NaClO + CO(NH2)2 ═ 3NaCl + NaHCO3 + N2↑ + 2H2O;
(3)氯化镁易水解,为防止氯化镁水解,在制取氯化镁时,要将MgCl26H2O放在氯化氢气体中;
(4)溴具有强氧化性,二氧化硫具有还原性,二者在水溶液里能发生氧化还原反应生成硫酸和氢溴酸,离子反应方程式为SO2+Br2+2H2O═4H++SO42-+2Br-,当二氧化硫少量时,二者反应生成(NH4)2SO3,当二氧化硫过量时,二者反应生成NH4HSO3。
【点晴】
准确的流程分析是解题关键,向盐卤溶液中加入NaClO,NaClO具有强氧化性,能将Fe2+氧化为Fe3+,向盐卤中加入少量NaOH,NaOH和Fe3+反应生成Fe(OH)3,CO(NH2)2和NaClO发生氧化还原反应,生成物除盐外,都是能参与大气循环的物质,所以生成物是NaCl、CO2、N2、H2O,过量二氧化碳能和NaOH反应生成碳酸氢钠,将溶液过滤得到的滤渣是Fe(OH)3,滤液I中含有Mg2+、Cl-、Na+,将滤液I蒸发、结晶、过滤得到MgCl26H2O,则滤液中含有的杂质离子是Na+,直接将MgCl26H2O加强热能得到MgO,发生反应MgCl26H2O![]() MgO+2HCl↑+5H2O↑,氯化镁易水解,所以不能用加热MgCl26H2O方法制取氯化镁,要在HCl氛围中制取氯化镁;据此可解答。
MgO+2HCl↑+5H2O↑,氯化镁易水解,所以不能用加热MgCl26H2O方法制取氯化镁,要在HCl氛围中制取氯化镁;据此可解答。

 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案【题目】影响化学反应速率的因素很多,某校化学小组用实验的方法进行探究。
实验一:他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5 mol·L-1、2 mol·L-1、18.4 mol·L-1)设计实验方案来研究影响化学反应速率的因素。甲同学的实验报告如下表:
实验步骤 | 现象 | 结论 |
①分别取等体积的2 mol·L-1的硫酸于试管中 | 反应速率Mg>Fe,Cu不反应 | 金属的性质越活泼,反应速率越快 |
②____________ | 反应物浓度越大,反应速率越快 |
(1)甲同学表中实验步骤②为_________________________________________。
(2)甲同学的实验目的是_____________;要得出正确的实验结论,还需控制的实验条件是____________。乙同学为了更精确地研究浓度对反应速率的影响,利用如图所示装置进行定量实验。

(3)乙同学在实验中应该测定的数据是___________________________________________________。
(4)乙同学完成该实验应选用的实验药品是________,该实验中不选用某浓度的硫酸,理由是___________。
实验二:已知 2KMnO4+5H2C2O4+3H2SO4===K2SO4+2MnSO4+8H2O+10CO2↑,在高锰酸钾酸性溶液和草酸溶液反应时,发现开始一段时间,反应速率较慢,溶液褪色不明显;但不久突然褪色,反应速率明显加快。
(5)针对上述实验现象,丙同学认为KMnO4与H2C2O4反应放热,导致溶液温度升高,反应速率加快。从影响化学反应速率的因素看,你猜想还可能是______________的影响。
(6)若用实验证明你的猜想,除高锰酸钾酸性溶液、草酸溶液外,还需要选择的试剂最合理的是________(填字母)。
A.硫酸钾 B.硫酸锰 C.二氯化锰 D.水