题目内容
【题目】某种锂离子电池的正极材料是将含有钴酸锂(LiCoO2)的正极粉均匀涂覆在铝箔上制成的,可以再利用。某校研究小组尝试回收废旧正极材料中的钴。
(1)钴酸锂(LiCoO2)改写为氧化物形式为 。
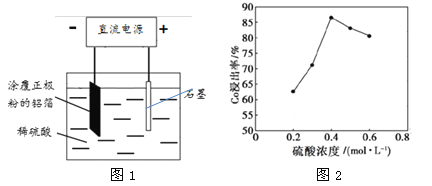
(2)25℃时,用图1所示装置进行电解,有一定量的钴以Co2+的形式从正极粉中浸出,且两极均有气泡产生,一段时间后正极粉与铝箔剥离。
①阴极的电极反应式为:LiCoO2+4H++e-=Li++Co2++2H2O、 。阳极的电极反应式为 。
②该研究小组发现硫酸浓度对钴的浸出率有较大影响,一定条件下,测得其变化曲线如图2所示。当c(H2SO4)>0.4mol·L-1时,钴的浸出率下降,其原因可能为 。
(2)电解完成后得到含Co2+的浸出液,且有少量正极粉沉积在电解槽底部。用以下步骤继续回收钴。
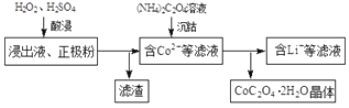
①写出“酸浸”过程中正极粉发生反应的化学方程式 。该过程中也可以用Na2S2O3代替H2O2,则反应的离子方程式为 。
②已知(NH4)2C2O4溶液呈弱酸性,下列关系中正确的是 (填字母序号)。
A.c(NH4+)>c(C2O42-)>c(H+)>c(OH-)
B.c(H+)+c(NH4+)=c(OH-)+c(HC2O4-)+c(C2O42-)
C.c(NH4+)+c(NH3H2O )=2[c(C2O42-)+c(HC2O4-)+c(H2C2O4)]
(4)已知所用锂离子电池的正极材料为xg,其中LiCoO2(M=98g·mol-1)的质量分数为a%,则回收后得到CoC2O42H2O(M=183g·mol-1)的质量不高于 g。
【答案】(1)Li2O·Co2O3
(2)①2H++2e-═H2↑;4OH--4e-═O2↑+2H2O②H+与LiCoO2在阴极的还原反应相互竞争,当c(H+)增大时,参与放电的H+增多(或有利于H+放电),所以钴的浸出率下降;
(3)①2LiCoO2+H2O2+3H2SO4═Li2SO4+2CoSO4+O2↑+4H2O
8LiCoO2+Na2S2O3+11H2SO4═4Li2SO4+8CoSO4+ Na2SO4+11H2O②ac
(4)![]()
【解析】
试题分析:(1)钴酸锂(LiCoO2)改写为氧化物形式为Li2O·Co2O3,故答案为:Li2O·Co2O3;
(2)①H + 也会在阴极放电,2H + + 2e-═H2↑;阴离子在阳极放电,4OH--4e-═O2↑ + 2H2O,故答案为:2H + + 2e-═H2↑;4OH--4e-═O2↑ + 2H2O;
②如图2所示.当c(H2SO4)>0.4molL-1时,参与放电的H + 增多(或有利于H + 放电),所以钴的浸出率下降,故答案为:H + 与LiCoO2在阴极的还原反应相互竞争,当c(H + )增大时,参与放电的H + 增多(或有利于H + 放电),所以钴的浸出率下降;
(2)①“酸浸”过程中正极粉发生氧化还原反应,LiCoO2被还原生成Co2 + ,H2O2被氧化生成O2,方程式为2LiCoO2 + H2O2 + 3H2SO4═Li2SO4 + 2CoSO4 + O2↑ + 4H2O;用Na2S2O3代替H2O2,LiCoO2被还原生成Co2 + ,Na2S2O3被氧化生成Na2SO4,则反应的离子方程式为8LiCoO2 + Na2S2O3 + 11H2SO4═4Li2SO4 + 8CoSO4 + Na2SO4 + 11H2O,故答案为:2LiCoO2 + H2O2 + 3H2SO4═Li2SO4 + 2CoSO4 + O2↑ + 4H2O;8LiCoO2 + Na2S2O3 + 11H2SO4═4Li2SO4 + 8CoSO4 + Na2SO4 + 11H2O;
②(NH4)2C2O4溶液呈弱酸性,a.由离子浓度大小关系,知c (NH4 + )>c(C2O42-)>c (H + )>c (OH-),故a正确;b.由电荷守恒,可知c (H + ) + c (NH4 + )=c (OH-) + c(HC2O4-) + 2c(C2O42-),故b错误;c.由物料守恒,可知c (NH4 + ) + c (NH3H2O)=2[c(C2O42-) + c(HC2O4-) + c(H2C2O4)],故c正确;故答案为:ac;
(3)根据关系式:
LiCoO2~CoC2O42H2O
98 183
xa%g m
解之得m=![]() ,故答案为:
,故答案为:![]() 。
。

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案