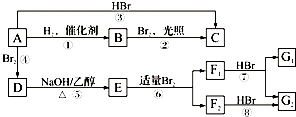
题目内容
【题目】能源是人类生存和发展的重要支柱,研究化学反应过程中的能量变化在能源紧缺的今天具有重要的理论意义,已知下列热化学方程式 ①H2(g)+ ![]() O2(g)=H2O(g)△H=﹣242kJ/mol;
O2(g)=H2O(g)△H=﹣242kJ/mol;
②2H2(g)+O2(g)=2H2O(l)△H=﹣572kJ/mol;
③C(s)+ ![]() O2(g)=CO(g)△H=﹣110.5kJ/moL;
O2(g)=CO(g)△H=﹣110.5kJ/moL;
④C(s)+O2(g)=CO2(g)△H=﹣393.5kJ/moL;
⑤CO2(g)+2H2O(g)=CH4(g)+2O2(g)△H=+802kJ/moL
化学键 | O=O | C﹣C | H﹣H | O﹣O | C﹣O | O﹣H | C﹣H |
键能kJ/mol | 497 | 348 | 436 | 142 | 351 | 463 | 414 |
回答下列问题
(1)写出能表示H2燃烧热的热化学方程式:
(2)计算C(s)+H2O(g)H2(g)+CO(g)△H=kJ/moL;
(3)估算出C=O键能为kJ/moL.
(4)CH4的燃烧热△H=﹣kJ/moL.
(5)25℃、101kPa下,某燃具中CH4的燃烧效率是90%(注:相当于10%的CH4未燃烧),水壶的热量利用率是70%,则用此燃具和水壶,烧开1L水所需要的CH4的物质的量为mol[保留到小数点后2位;c (H2O)=4.2J/(g℃)].
【答案】
(1)H2(g)+0.5 O2(g)=H2O(l)△H=﹣286kJ/mol
(2)+131.5
(3)800
(4)890
(5)0.56
【解析】解:(1)因燃烧热在某一温度和压强下lmol某物质B完全燃烧生成稳定化合物时所释放出的热量,由②可得H2的燃烧热为286kJmol﹣1;所以热化学方程式为:H2(g)+0.5 O2(g)=H2O(l)△H=﹣286kJ/mol,故答案为:H2(g)+0.5 O2(g)=H2O(l)△H=﹣286kJ/mol;(2)因③﹣①可得:C(s)+H2O(g)=H2(g)+CO (g)△H=+131.5kJmol﹣1,故答案为:+131.5;(3)CO2(g)+2H2O(g)═CH4(g)+2O2(g)△H═+802kJ/moL,设C=O键能为x,
反应焓变△H=反应物键能总和﹣生成物键能总和=2x+2×2×463KJ/mol﹣(4×414KJ/mol+2×497KJ/mol)=802KJ/mol
x=800KJ/mol;故答案为:800;(4)①H2(g)+ ![]() O2(g)═H2O(g)△H═﹣242kJ/mol;②H2(g)+
O2(g)═H2O(g)△H═﹣242kJ/mol;②H2(g)+ ![]() O2(g)=H2O(l)△H=﹣286kJ/mol;⑤CO2(g)+2H2O(g)═CH4(g)+2O2(g)△H═+802kJ/moL[①×2﹣②]﹣⑤,CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H═890KJ/mol;故答案为:890;(5)25℃、101kPa下,某燃具中CH4的燃烧效率是90%(注:相当于10%的CH4未燃烧),水壶的热量利用率是70%,则用此燃具和水壶,烧开1L水所需要的CH4的物质的量设为x,依据甲烷的燃烧热CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H═890KJ/mol,计算得到:
O2(g)=H2O(l)△H=﹣286kJ/mol;⑤CO2(g)+2H2O(g)═CH4(g)+2O2(g)△H═+802kJ/moL[①×2﹣②]﹣⑤,CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H═890KJ/mol;故答案为:890;(5)25℃、101kPa下,某燃具中CH4的燃烧效率是90%(注:相当于10%的CH4未燃烧),水壶的热量利用率是70%,则用此燃具和水壶,烧开1L水所需要的CH4的物质的量设为x,依据甲烷的燃烧热CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H═890KJ/mol,计算得到:
90%×890KJ/mol×70%=1000g×4.2×10﹣3KJ/g℃×(100﹣25)℃×x
x=0.56故答案为:0.56.
(1)因燃烧热在某一温度和压强下lmol某物质B完全燃烧生成稳定化合物时所释放出的热量,由②可得H2的燃烧热为286kJmol﹣1;(2)根据方程式①、③运用盖斯定律求得反应热;(3)依据反应⑤的反应焓变,结合焓变=反应物键能总和﹣生成物键能总和;(4)燃烧热概念是1mol可燃物完全燃烧生成稳定氧化物的过程中放出的热量,结合①②⑤热化学方程式和盖斯定律计算;(5)根据题意求出的甲烷燃烧热计算CH4的燃烧效率是90%(注:相当于10%的CH4未燃烧),水壶的热量利用率是70%时放出的热量,再根据水烧开需要的热量计算需要甲烷的物质的量.

【题目】人们常用催化剂来选择反应进行的方向.如图所示为一定条件下1mol CH3OH与O2发生反应时,生成CO、CO2或HCHO的能量变化图[反应物O2(g)和生成物H2O(g)略去].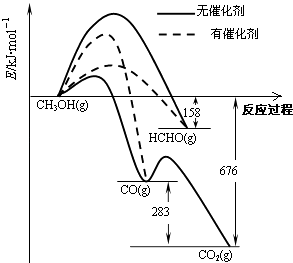
(1)①在有催化剂作用下,CH3OH与O2反应主要生成(填“CO、CO2”或“HCHO”).2HCHO(g)+O2(g)═2CO(g)+2H2O(g)△H= .
②甲醇制取甲醛可用Ag作催化剂,含有AgCl会影响Ag催化剂的活性.用氨水可以溶解除去其中的AgCl,写出该反应的离子方程式: .
(2)已知:CO(g)+2H2(g)CH3OH(g)△H=﹣a kJmol﹣1 .
①经测定不同温度下该反应的平衡常数如下:
温度(℃) | 250 | 300 | 350 |
K | 2.041 | 0.270 | 0.012 |
若某时刻、250℃测得该反应的反应物与生成物的浓度为c(CO)=0.4molL﹣1、c(H2)=0.4molL﹣1、c(CH3OH)=0.8molL﹣1 , 则此时v正v逆(填“>”、“<”或“=”).
②某温度下,在体积固定的2L的密闭容器中将1mol CO和2mol H2混合,测得不同时刻的反应前后压强关系如下:
时间(min) | 5 | 10 | 15 | 20 | 25 | 30 |
压强比(P后/P前) | 0.98 | 0.90 | 0.80 | 0.70 | 0.70 | 0.70 |
则0~15min,用H2表示的平均反应速率为 , 达到平衡时CO的转化率为 .
(3)利用钠碱循环法可除去SO2 , 消除SO2对环境的污染.吸收液吸收SO2的过程中,pH随n(SO32﹣):n(HSO3﹣)变化关系如下表:
n(SO32﹣):n(HSO3﹣) | 91:9 | 1:1 | 1:91 |
pH | 8.2 | 7.2 | 6.2 |
①根据上表判断NaHSO3溶液显性.
②在NaHSO3溶液中离子浓度关系正确的是 (填字母).
a.c(Na+)=2c(SO32﹣)+c(HSO3﹣)
b.c(Na+)>c(HSO3﹣)>c(H+)>c(SO32﹣)>c(OH﹣)
c.c(H2SO3)+c(H+)=c(SO32﹣)+(OH﹣)
d.c(Na+)+c(H+)=c(SO32﹣)+c(HSO3﹣)+c(OH﹣)