题目内容
【题目】目前正研究利用催化技术将尾气中的NO和CO转变成CO2和N2,化学方程式如下:2NO+2CO![]() 2CO2+N2+Q为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如下表
2CO2+N2+Q为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度如下表
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/mol·L-1 | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
c(CO)/mol·L-1 | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)前2s内的平均反应速率v(N2)=____________;
(2)假设在密闭容器中发生上述反应,达到平衡时下列措施能提高CO转化率的是_______;
A. 选用更有效的催化剂 B. 升高反应体系的温度
C. 降低反应体系的温度 D. 缩小容器的体积
(3)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中;请在下表空格中填入剩余的实验条件数据。
实验 编号 | T/℃ | NO初始浓度 (mol/L) | CO初始浓度 (mol/L) | 催化剂的比表面积 (m2/g) |
Ⅰ | 280 | 1.20×10-3 | 5.80×10-3 | 82 |
Ⅱ | __________ | __________ | __________ | 124 |
Ⅲ | 350 | ________ | ____________ | 124 |
(4)请画出题表中的三个实验条件下混合气体中CO浓度随时间变化的趋势曲线图,并标明各条曲线的实验编号。______________
(5)消除一氧化氮可以用在水的存在下通入氧气加以除去。现将标准状况下的一试管一氧化氮气体倒置于水中,慢慢通入氧气,溶液充满整个试管,若不考虑溶质的扩散,则试管内稀硝酸的浓度为_________mol/L;若继续通入氧气,将试管内溶液排除一半,则剩余稀硝酸的浓度为__________mol/L。
(6)利用氨气的还原性也可以除去氮氧化合物(NOx),当氨气与NOx等物质的量恰好反应生成氮气和水,则x=_________。
【答案】1.875×10-4 mol/(Ls) CD 280 1.20×10-3 5.80×10-3 1.20×10-3 5.80×10-3 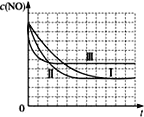 0.045 0.045 1.5
0.045 0.045 1.5
【解析】
(1)依据化学反应速率的概念结合图表数据分析计算一氧化氮的反应速率,结合速率之比等于系数之比;
(2)提高NO转化率,平衡正向进行;
(3)根据实验目的验证温度、催化剂比表面积对化学反应速率的影响规律,则应保证浓度相同,然后相同温度时比较催化剂比表面积,相同催化剂比表面积时比较温度;
(4)利用影响化学反应速率及化学平衡的因素来分析图象,利用影响化学反应速率及化学平衡的因素来分析、完成实验条件下混合气体中NO浓度随时间变化的趋势曲线图;
(5)据原子守恒,NO的物质的量与硝酸的物质的量相同,假设试管体积为V L,可以求算出NO气体的物质的量;充入氧气排出![]() 体积的溶液,剩余溶液浓度不变;
体积的溶液,剩余溶液浓度不变;
(6)依据氧化还原反应中得失电子守恒解答。
(1)前2s内的平均反应速度v(NO)=![]() =3.75×10-4 mol/(Ls),由于用不同物质表示的化学反应速率,速率比等于化学计量数的比,v(N2):v(NO)=1:2,可得到v(N2)=1.875×10-4 mol/(Ls);
=3.75×10-4 mol/(Ls),由于用不同物质表示的化学反应速率,速率比等于化学计量数的比,v(N2):v(NO)=1:2,可得到v(N2)=1.875×10-4 mol/(Ls);
(2)对于反应2NO+2CO![]() 2CO2+N2,该反应的正反应是气体体积减小的放热反应。
2CO2+N2,该反应的正反应是气体体积减小的放热反应。
A. 选用更有效的催化剂,只能改变反应速率,不能改变平衡,A错误;
B. 反应是放热反应,升高反应体系的温度,化学平衡逆向进行,CO的转化率减小,B错误;
C. 反应是放热反应,降低反应体系的温度,平衡正向进行,CO转化率增大,C正确;
D. 缩小容器的体积,压强增大,平衡向气体体积减小的方向进行,平衡正向进行,CO转化率增大,D正确;
故合理选项是CD;
(3)因Ⅰ、Ⅱ比表面积不同,则应控制温度相同,所有物质的浓度应控制相同来验证催化剂比表面积对速率的影响;故反应条件:温度T=280℃;c(NO)= 1.20×10-3 mol/L;c(CO)=5.80×10-3 mol/L;
Ⅱ、Ⅲ比表面积相同,温度不同,则所有浓度应控制相同来验证反应温度对速率的影响;,
故反应条件:c(NO)= 1.20×10-3 mol/L;c(CO)=5.80×10-3 mol/L;
(4)因Ⅰ、Ⅱ温度相同,催化剂对平衡移动无影响,则平衡不移动,但Ⅱ的速率大,则Ⅱ先达到化学平衡,Ⅰ、Ⅱ达平衡时NO的浓度相同,NO起始浓度为1.20×10-3 mol/L;Ⅰ、Ⅱ与Ⅲ的起始浓度相同,Ⅲ催化剂的比表面积等于Ⅱ大于Ⅰ,温度高于Ⅰ和Ⅱ,反应放热,升温时NO转化率降低,达到平衡所用时间短,所以表中的Ⅰ、Ⅱ、Ⅲ三个实验条件下混合气体中NO浓度随时间变化的趋势曲线图为: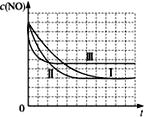 ;
;
(5)据原子守恒,NO的物质的量与硝酸的物质的量相同,假设试管体积为V L,则n(NO)=n(HNO3)=![]() mol,溶液充满整个试管,则硝酸溶液的体积为V L,则硝酸溶液的浓度c(HNO3)
mol,溶液充满整个试管,则硝酸溶液的体积为V L,则硝酸溶液的浓度c(HNO3)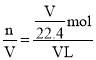 =
=![]() mol/L=0.45 mol/L;充入氧气排出
mol/L=0.45 mol/L;充入氧气排出![]() 体积的溶液,剩余溶液浓度不变,故剩余溶液的浓度为0.045 mol/L;
体积的溶液,剩余溶液浓度不变,故剩余溶液的浓度为0.045 mol/L;
(6)假设有氨气1 mol,氨气与NOx等物质的量恰好反应生成N2和水,则1 mol氨气失去电子1.5 mol,据氧化还原反应中电子守恒,1 mol NOx得电子1.5 mol,所以x=1.5。

 阅读快车系列答案
阅读快车系列答案