题目内容
研究NO2、SO2、CO等大气污染气体的处理以及燃料的开发与利用有重要意义.
(1)NO2可用水吸收,利用反应6NO2+8NH3
7N2+12H2O也可以处理NO2.当转移1.2mol电子时,消耗的NO2在标准状况下是______L.
(2)已知:2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ?mol-1
2NO(g)+O2(g)?2NO2(g)△H=-113.0kJ?mol-1
则反应NO2(g)+SO2(g)?SO3(g)+NO(g)的△H=______kJ?mol-1
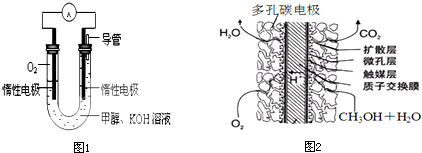
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)?CH3OH(g).由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量是现用镍氢电池和锂电池的10倍,可连续使用1个月充电一次.假定放电过程中,甲醇完全氧化产生的CO2被充分吸收生成CO32-
①该电池反应的总离子方程式为______.
②甲醇在______极发生反应(填正或负),电池在放电过程中溶液的pH将______(填降低或上升、不变);若有16克甲醇蒸气被完全氧化,产生的电能电解足量的CuSO4溶液,(假设整个过程中能量利用率为80%),则将产生标准状况下的O2______升.
(1)NO2可用水吸收,利用反应6NO2+8NH3
| 催化剂 |
| △ |
(2)已知:2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ?mol-1
2NO(g)+O2(g)?2NO2(g)△H=-113.0kJ?mol-1
则反应NO2(g)+SO2(g)?SO3(g)+NO(g)的△H=______kJ?mol-1
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)?CH3OH(g).由甲醇和氧气以及强碱做电解质溶液的新型手机电池,电量是现用镍氢电池和锂电池的10倍,可连续使用1个月充电一次.假定放电过程中,甲醇完全氧化产生的CO2被充分吸收生成CO32-
①该电池反应的总离子方程式为______.
②甲醇在______极发生反应(填正或负),电池在放电过程中溶液的pH将______(填降低或上升、不变);若有16克甲醇蒸气被完全氧化,产生的电能电解足量的CuSO4溶液,(假设整个过程中能量利用率为80%),则将产生标准状况下的O2______升.
(1)反应6NO2+8NH3
7N2+12H2O可以处理NO2,由化学方程式可知,6mol二氧化氮反应的转移为24mol,当转移1.2mol电子时,消耗的二氧化氮气体物质的量为0.3mol,消耗的NO2在标准状况下=0.3mol×22.4L/mol=6.72L,
故答案为:6.72;
(2)①2SO2(g)+O2(g)?2SO3 (g)△H=-196.6kJ?mol-1
②2NO(g)+O2(g)?2NO2(g)△H=-113.0kJ?mol-1
由盖斯定律①-②得到:2NO2(g)+2SO2(g)?2SO3(g)+2NO(g)的△H=-83.6KJ/mol,
则反应NO2(g)+SO2(g)?SO3(g)+NO(g)的△H=-41.8KJ/mol,
故答案为:-41.8;
(3)①放电过程中,甲醇完全氧化产生的CO2被充分吸收生成CO32-,反应的离子方程式为:2CH3OH+3O2+4OH-=2CO32-+6H2O,
故答案为:2CH3OH+3O2+4OH-=2CO32-+6H2O;
②甲醇燃料电池中燃料在负极失电子发生氧化反应,电池在放电过程中,氢氧化钾消耗,溶液的pH下降,若有16克甲醇蒸气被完全氧化,产生的电能电解足量的CuSO4溶液,依据电子守恒CH3OH~CO32-~6e-,16克甲醇物质的量为0.5mol,转移电子为3mol,整个过程中能量利用率为80%,用于电解硫酸铜溶液的电子=3×80%=2.4mol,依据电子守恒O2~4e-,则将产生标准状况下的O2物质的量为0.6mol,标准状况下氧气的体积=0.6mol×22.4L/mol=13.44L,
故答案为:2CH3OH+3O2+4OH-=2CO32-+6H2O;负;下降;13.44.
| 催化剂 |
| △ |
故答案为:6.72;
(2)①2SO2(g)+O2(g)?2SO3 (g)△H=-196.6kJ?mol-1
②2NO(g)+O2(g)?2NO2(g)△H=-113.0kJ?mol-1
由盖斯定律①-②得到:2NO2(g)+2SO2(g)?2SO3(g)+2NO(g)的△H=-83.6KJ/mol,
则反应NO2(g)+SO2(g)?SO3(g)+NO(g)的△H=-41.8KJ/mol,
故答案为:-41.8;
(3)①放电过程中,甲醇完全氧化产生的CO2被充分吸收生成CO32-,反应的离子方程式为:2CH3OH+3O2+4OH-=2CO32-+6H2O,
故答案为:2CH3OH+3O2+4OH-=2CO32-+6H2O;
②甲醇燃料电池中燃料在负极失电子发生氧化反应,电池在放电过程中,氢氧化钾消耗,溶液的pH下降,若有16克甲醇蒸气被完全氧化,产生的电能电解足量的CuSO4溶液,依据电子守恒CH3OH~CO32-~6e-,16克甲醇物质的量为0.5mol,转移电子为3mol,整个过程中能量利用率为80%,用于电解硫酸铜溶液的电子=3×80%=2.4mol,依据电子守恒O2~4e-,则将产生标准状况下的O2物质的量为0.6mol,标准状况下氧气的体积=0.6mol×22.4L/mol=13.44L,
故答案为:2CH3OH+3O2+4OH-=2CO32-+6H2O;负;下降;13.44.

练习册系列答案
相关题目