题目内容
现有四种元素的基态原子的电子排布式如下:
①1s22s22p63s23p4 ②1s22s22p63s23p3 ③1s22s22p3 ④1s22s22p5
则下列有关比较中正确的是
| A.第一电离能:④>③>②>① |
| B.原子半径:④>③>②>① |
| C.电负性:④>③>②>① |
| D.最高正化合价:④>③=②>① |
A
解析试题分析:A.原子半径越小,失去电子越难,电离能越大。当原子核外各个轨道上的电子处于全充满、半充满或全空时是稳定的状态。因此第一电离能:④>③>②>①。正确。 B.①是S,②是P,属于同一周期的元素,原子序数越大,原子半径就越小。所以原子半径②>①;③是N;④是F,原子序数④>③,所以原子半径③>④。对于电子层数不同的元素来说,原子核外电子层数越多,原子半径就越大。因此原子半径②>①>③>④。错误。C.原子半径越小,元素的非金属性越强,其电负性就越大。故电负性:④>③>①>②。错误。D.一般情况下,元素的最高化合价与原子的最外层电子数相等。但是F、O由于电负性大,原子半径小,所以无最高正化合价。最高正化合价:=①>②=③>④。错误。
考点:考查元素的原子结构与元素性质的关系的知识。

练习册系列答案
相关题目
下列说法正确的是( )
| A.煤的干馏和石油的分馏均属化学变化 |
| B.酯类和糖类均能发生水解反应 |
| C.生活中常见的石英玻璃、陶瓷都属于硅酸盐产品 |
| D.合金材料都是导体,可能含有非金属元素 |
下列变化中,不需要破坏化学键的是
| A.三氧化硫溶于水 | B.次氯酸见光分解 | C.蔗糖溶于水 | D.氧气变成臭氧 |
下列物质中,既有离子键,又有共价键的是
| A.CaCl2 | B.Na2O | C.H2O | D.NH4Cl |
中学化学中很多“规律”都有其适用范围,下列根据有关“规律”推出的结论合理的是
| A.Na2O、Na2O2组成元素相同,推出与水反应产物也完全相同 |
| B.SO2和湿润的Cl2都有漂白性,推出二者混合后漂白性更强 |
| C.H2CO3的酸性比HClO强,推出CO2通入NaClO溶液中能生成HClO |
| D.根据常温下铜与浓硝酸可以制取NO2,推出常温下铁与浓硝酸也可以制取NO2 |
有关化学用语正确的是 ( )
| A.溴乙烷的分子式C2H5Br |
| B.乙醇的结构简式C2H6O |
C.四氯化碳的电子式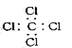 |
| D.乙烯的结构简式CH2CH2 |
NA为阿伏加德罗常数的数值,下列说法中正确的是
| A.在密闭容器中加入l.5mol H2和0.5molN2,充分反应后可得到NH3分子数为NA |
| B.一定条件下,2.3g的Na完全与O2反应生成3.6g产物时失去的电子数为0.1NA |
| C.1.0L的0.1 mol·L-1Na2S溶液中含有的S2-离子数为0.1NA |
| D.标准状况下,22.4L的CCl4中含有的CCl4分子数为NA |
用表示阿伏加德罗常数的数值,下列说法正确的是
| A.1 mol Na2O2晶体中共含有个离子 |
| B.0.1 molAlCl3完全水解转化为氢氧化铝胶体,生成0.1NA个胶粒 |
| C.常温常压下,和混合气体含有个氧原子 |
| D.电解法冶炼铝时每转移个电子,阳极生成氧气 |
实验室里需用480 mL 0.10 mol·L-1 CuSO4溶液,现选用500 mL容量瓶进行配制,以下操作正确的是
| A.称取7.68 g硫酸铜,加入500 mL水 |
| B.称取12.0 g胆矾配制500 mL溶液 |
| C.称取8.0 g硫酸铜,加入500 mL水 |
| D.称取12.5 g 胆矾配制500 mL溶液 |