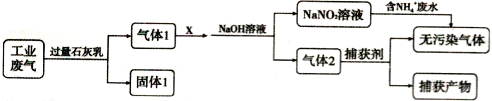
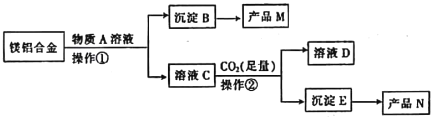
��Ŀ����
����Ŀ��ʵ�����Ʊ�1��2���������飬��16.0g������������Ҵ��Ʊ�1��2���������飬ʵ�������õ�9.4g��Ʒ��ʵ��װ����ͼ��ʾ��
��������
�Ҵ� | 1��2���������� | ���� | |
״̬ | ��ɫҺ�� | ��ɫҺ�� | ��ɫҺ�� |
�ܶ�/gcm��3 | 0.79 | 2.2 | 0.71 |
�е�/0C | 78.5 | 132 | 34.6 |
�۵�/0C | ��130 | 9 | ��116 |
�ܽ��� | ����ˮ | ����ˮ | ����ˮ |
��ش��������⣺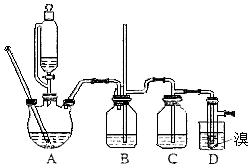
��1���ڴ��Ʊ�ʵ���У�Ҫ������Ѹ�ٵذѷ�Ӧ�¶���ߵ�170�����ң�����ҪĿ����������ȷѡ��ǰ����ĸ��
a��������Ӧ b���ӿ췴Ӧ�ٶ� c����ֹ�Ҵ��ӷ� d�����ٸ�������������
��2����װ��C��Ӧ���� �� ��Ŀ������������ȷѡ��ǰ����ĸ��
a��ˮ b��Ũ���� c������������Һ d������KMnO4��Һ
��3���жϸ��Ʊ���Ӧ�Ѿ���������ķ����� ��
��4����1��2����������ֲ�Ʒ���ڷ�Һ©���м�ˮ�����ã�����Ӧ���㣨��ϡ����¡�����
��5����װ��B�нϳ��������ܵ���������
��6����Ӧ������Ӧ����ˮ��ȴװ��D������ҪĿ���� �� ���ֲ��ܹ�����ȴ�����ñ�ˮ������ԭ������
��7����ʵ���У�1��2����������IJ���Ϊ ��
���𰸡�
��1��d
��2��c��������ϩ�е�������������
��3�������ɫ��ȫ��ȥ
��4����
��5����ֹ�������ж�װ���Ƿ����
��6����ϩ���巴Ӧʱ���ȣ���ȴ�ɱ�����Ĵ����ӷ���1��2��������������̵�ϵͣ�9�棩��������ȴ��ʹ�����̶�ʹ��·����
��7��50%
���������⣺��1���Ҵ���Ũ����140��������£�������������ˮ���������ѣ�����Ҫ������Ѹ�ٵذѷ�Ӧ�¶���ߵ�170�����ң�����ҪĿ���Ǽ��ٸ������������ɣ����Դ��ǣ�d����2��Ũ�������ǿ�����ԣ����Ҵ������ɶ�����̼����������ԭ�ɶ��������������ɵ���ϩ���ж�����̼�����������������壬Cװ������������������ϩ�е������������壬����װ��C��Ӧ��������������Һ����Ŀ����������ϩ�е������������壬���Դ��ǣ�c��������ϩ�е������������壻��3����ϩ����ˮ�����ӳɷ�Ӧ����1��2���������飬1��2����������Ϊ��ɫ�������жϸ��Ʊ���Ӧ�Ѿ���������ķ����������ɫ��ȫ��ȥ��
���Դ��ǣ������ɫ��ȫ��ȥ����4��1��2�����������ˮ�����ܣ�1��2�����������ܶȱ�ˮ�����Դ��ǣ��£���5��1��2�����������۵�Ϊ9�棬��ȴ�����������壬�����������ܣ�BΪ��ȫƿ�����Է�ֹ����������B�г���������Һ��ߵͱ仯�������ж��Ƿ���������
���Դ��ǣ���ֹ�������ж�װ���Ƿ��������6�����ڳ����£��ӷ�����ϩ���巴Ӧʱ���ȣ�����ӷ�����ȴ�ɱ�����Ĵ����ӷ�����1��2��������������̵�9��ϵͣ����ܹ�����ȴ��
���Դ��ǣ���ϩ���巴Ӧʱ���ȣ���ȴ�ɱ�����Ĵ����ӷ���1��2��������������̵�ϵͣ�9�棩��������ȴ��ʹ�����̶�ʹ��·��������7�����ݷ�Ӧ����ʽCH2=CH2+Br2��BrCH2CH2Br��֪��16.0g������������Ҵ��Ʊ�1��2���������������Ϊ16g�� ![]() =18.8g�����Բ���=
=18.8g�����Բ���= ![]() ��100%=
��100%= ![]() ��100%=50%��
��100%=50%��
���Դ��ǣ�50%��