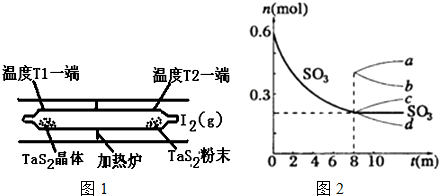
题目内容
4.下列说法不正确的是( )| A. | 有的化合反应不属于氧化还原反应 | |
| B. | 复分解反应部分属于氧化还原反应 | |
| C. | 置换反应一定是氧化还原反应 | |
| D. | CO与CuO反应不是置换反应,但属于氧化还原反应 |
分析 A、没有化合价变化的化合反应不属于氧化还原反应;
B、复分解反应中一定没有元素化合价的变化;
C、置换反应中一定存在元素化合价的变化;
D、CO与CuO反应生成铜和二氧化碳,不是置换反应,但C、Cu化合价变化,属于氧化还原反应.
解答 解:A.化合反应中有多种反应物,一种生成物(化合物),则只要没有化合价变化,则不属于氧化还原反应,故A正确;
B.复分解反应中没有元素化合价的变化,不属于氧化还原反应,故B错误;
C.置换反应中反应物中和生成物中各一种单质和一种化合物,但形成单质的元素不同,因此这两种元素的化合价一定发生了变化,属于氧化还原反应,故C正确;
D.CO与CuO反应生成铜和二氧化碳,不是置换反应,但C、Cu化合价变化,属于氧化还原反应,故D正确.
故选:B.
点评 本题考查学生氧化还原反应和四大基本反应类型之间的关系知识,注意把握氧化还原反应的特征及判断方法,较简单.

练习册系列答案
相关题目
12.设NA表示阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 标准状况下,11.2L乙醇中含有的碳氢键数为2.5NA | |
| B. | 常温常压下,28gC2H4、CO的混合气体中含有碳原子的数目为1.5NA | |
| C. | 常温下,20LpH=12的Na2CO3溶液中含有的OH-离子数为0.2NA | |
| D. | 标准状况下,2.24LCl2与足量的NaOH溶液反应,转移的电子数目为0.2NA |
19.除去表中物质中含有杂质,所选试剂错误的是( )
| 选项 | 物质 | 杂质 | 试剂及操作 |
| A | 氢氧化钠 | 硫酸钠 | 加入适量氢氧化钙,过滤 |
| B | 生石灰 | 碳酸钙 | 高温锻烧 |
| C | 二氧化碳 | 一氧化碳 | 通过有足量灼烧氧化铁的玻璃管 |
| D | 氧化铜粉末 | 木炭粉 | 隔绝空气加强热 |
| A. | A | B. | B | C. | C | D. | D |
9.下列各组物质中,互为同分异构体的是( )
| A. | 油与脂肪 | B. | 淀粉与纤维素 | C. | 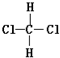 和 和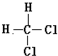 | D. | 正丁烷和异丁烷 |
13.已知可逆反应:2N2H4(g)+2NO2(g)?3N2(g)+4H2O(g)△H>0.下列有关说法正确的是( )
| A. | 加压有利于化学平衡向正反应方向移动 | |
| B. | 该反应的化学平衡常数表达式为:K=$\frac{{c}^{2}{N}_{2}{H}_{4}×{c}^{2}N{O}_{2}}{{c}^{3}{N}_{2}×{c}^{4}{H}_{2}O}$ | |
| C. | 升高温度可缩短反应达平衡的时间但不能提高平衡转化率 | |
| D. | 使用催化剂可缩短反应达平衡的时间但不能提高平衡转化率 |




 将0.1mol MnO2粉末加入到50mL过氧化氢溶液(H2O2,ρ=1.1g/mL)中,在标准状况下放出气体的体积和时间的关系如图所示.
将0.1mol MnO2粉末加入到50mL过氧化氢溶液(H2O2,ρ=1.1g/mL)中,在标准状况下放出气体的体积和时间的关系如图所示.