题目内容
【题目】加热条件下浓硫酸能将木炭粉氧化成CO2,本身被还原成SO2。试用如图所列各装置设计一个实验,来验证上述反应所产生的各种产物。
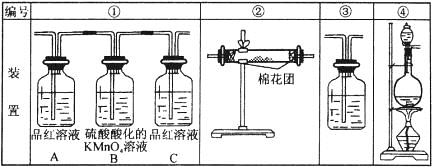
(1)这些装置的连接顺序是(按产物气流从左至右的方向,填写装置的编号):______→____→____→____。
(2)实验时可观察到装置①中A瓶的溶液褪色。A瓶溶液的作用是_________,B瓶溶液的作用是_______, C瓶溶液的作用是________________。写出B中发生的离子方程式__________。
(3)装置②中所加的固体药品是____________,可验证的产物是____________。
(4)装置③中所盛溶液是_____________,可验证的产物是__________。
【答案】④→②→①→③验证产物中有SO2将产物中SO2全部氧化吸收确认产物中SO2已被全部吸收5SO2+ 2MnO4-+2H2O= 5SO42- +2Mn2++4H+无水硫酸铜水蒸气澄清石灰水CO2
【解析】
(1)二氧化碳和二氧化硫都能使澄清石灰水变浑浊,但二氧化硫能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,能使品红溶液褪色而具有漂白性,但二氧化碳没有此性质,所以检验二氧化碳之前先检验二氧化硫,水蒸气用无水硫酸铜检验,仪器连接顺序是:气体制备→水蒸气检验→二氧化硫检验→除去二氧化硫→二氧化硫检验→二氧化碳检验,所以其连接顺序是④→②→①→③;
(2)实验时可观察到装置①中A瓶的溶液褪色c瓶的溶液不褪色,说明通过c瓶后气体中不含二氧化硫,A的作用是检验二氧化硫,利用品红溶液褪色检验二氧化硫;二氧化硫具有还原性、酸性高锰酸钾具有强氧化性,二者发生氧化还原反应而使酸性高锰酸钾溶液褪色,所以B的作用是除去二氧化硫;C的作用是检验二氧化硫是否存在,防止干扰二氧化碳检验;B中SO2使酸性高锰酸钾溶液褪色,发生反应的离子方程式为5SO2+ 2MnO4-+2H2O= 5SO42- +2Mn2++4H+;
(3)水蒸气能使无水硫酸铜由无色变为蓝色,可以用无水硫酸铜检验水蒸气,所以装置②中所装的固体药品是无水硫酸铜,其验证的产物是水;
(4)二氧化碳能使澄清石灰水变浑浊,所以实验室用澄清石灰水检验二氧化碳,则装置③中所盛溶液是澄清石灰水。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案