题目内容
【题目】研究NO2、SO2 、CO等大气污染气体的处理具有重要意义。
(1)NO2可用水吸收,相应的化学反应方程式为______________________。利用反应6NO2+8NH3 ![]() 7N2+12 H2O也可处理NO2。当转移1.2 mol电子时,消耗的NO2在标准状况下是__________L。
7N2+12 H2O也可处理NO2。当转移1.2 mol电子时,消耗的NO2在标准状况下是__________L。
2)已知:2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-196.6 kJ·mol-1
2SO3(g) ΔH=-196.6 kJ·mol-1
2NO(g)+O2(g)![]() 2NO2(g) ΔH=-113.0 kJ·mol-1
2NO2(g) ΔH=-113.0 kJ·mol-1
则反应NO2(g)+SO2(g)![]() SO3(g)+NO(g)的ΔH=_________kJ·mol、1。
SO3(g)+NO(g)的ΔH=_________kJ·mol、1。
一定条件下,将NO2与SO2以体积比1︰2置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是
a.体系压强保持不变
b.混合气体颜色保持不变
c.SO3和NO的体积比保持不变
d.每消耗1 mol SO3的同时生成1 mol NO2
测得上述反应平衡时NO2与SO2体积比为1︰6,则平衡常数K=__________________。
(3)CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)![]() CH3OH(g)。
CH3OH(g)。
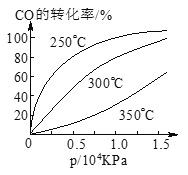
CO在不同温度下的平衡转化率与压强的关系如图所示。该反应ΔH___________0(填“>”或“ <”)。实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是________________________。
【答案】3NO2+H20=HNO3+NO 6.72 -41.8 b
8/3 < 此压强下,一氧化碳转化率接近100%
【解析】
试题解析:(1)二氧化氮与水反应生成硝酸和一氧化氮;3NO2+H20=HNO3+NO;6NO2+8NH3 ![]() 7N2+12 H2O也可处理NO2。该反应转移电子24摩尔e-, 生成氮气7摩尔;当转移1.2 mol电子时,消耗的NO2在标准状况下1.2×7×22.4/24=6.72L; 2)根据盖斯定律,处理两个方程式,消去氧气,得到NO2(g)+SO2(g)
7N2+12 H2O也可处理NO2。该反应转移电子24摩尔e-, 生成氮气7摩尔;当转移1.2 mol电子时,消耗的NO2在标准状况下1.2×7×22.4/24=6.72L; 2)根据盖斯定律,处理两个方程式,消去氧气,得到NO2(g)+SO2(g)![]() SO3(g)+NO(g)的ΔH=-41.8 kJ·mol、1。达到平衡状态:a.反应前后为体积不变的反应,所以反应体系压强任何时候都保持不变;错误;b.混合气体颜色保持不变,即二氧化氮气体的浓度不变,达平衡状态;正确;c.SO3和NO为生成物,任何时候体积比都保持不变,无法确定;错误;d.每消耗1 mol SO3为逆反应速率,同时生成1 mol NO2为逆反应速率,方向相同,无法判断;错误;答案为b;测得上述反应平衡时NO2与SO2体积比为1︰6,
SO3(g)+NO(g)的ΔH=-41.8 kJ·mol、1。达到平衡状态:a.反应前后为体积不变的反应,所以反应体系压强任何时候都保持不变;错误;b.混合气体颜色保持不变,即二氧化氮气体的浓度不变,达平衡状态;正确;c.SO3和NO为生成物,任何时候体积比都保持不变,无法确定;错误;d.每消耗1 mol SO3为逆反应速率,同时生成1 mol NO2为逆反应速率,方向相同,无法判断;错误;答案为b;测得上述反应平衡时NO2与SO2体积比为1︰6,
NO2(g)+SO2(g)![]() SO3(g)+NO(g)
SO3(g)+NO(g)
起始 a 2a 0 0
变化 x x x x
平衡 a-x 2a- x x x
(a-x)/(2a-x)=1/6,x=4a/5;则平衡常数K=x2/(a-x)×(2a-x)=8/3;(3)CO(g)+2H2(g)![]() CH3OH(g)。压强不变,温度由350℃降到300℃,一氧化碳的转化率增大,平衡右移,正反应放热;ΔH《0;实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是此压强下,一氧化碳转化率接近100%;
CH3OH(g)。压强不变,温度由350℃降到300℃,一氧化碳的转化率增大,平衡右移,正反应放热;ΔH《0;实际生产条件控制在250℃、1.3×104kPa左右,选择此压强的理由是此压强下,一氧化碳转化率接近100%;

 阅读快车系列答案
阅读快车系列答案【题目】在一定温度下,固定体积为2L密闭容器中,发生反应:
2SO2(g)+O2(g)![]() 2SO3(g ) ΔH <0,n(SO2)随时间的变化如表:
2SO3(g ) ΔH <0,n(SO2)随时间的变化如表:
时间/min | 0 | 1 | 2 | 3 | 4 | 5 |
n(SO2)/mol | 0.20 | 0.16 | 0.13 | 0.11 | 0.08 | 0.08 |
则下列说法正确的是
A. 当v(SO2)=v(SO3)时,说明该反应已达到平衡状态
B. 用O2表示0~4 min内该反应的平均速率为0.005 mol/(L·min)
C. 平衡时再通入O2,平衡右移,O2转化率减小,SO2转化率增大
D. 若升高温度,则SO2的反应速率会变大,平衡常数K值会增大