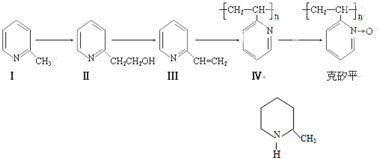
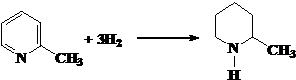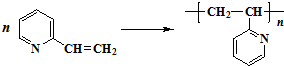题目内容
 在一定条件下进行的下列化学反应,请根据以下的转化关系回答下列问题.
在一定条件下进行的下列化学反应,请根据以下的转化关系回答下列问题.
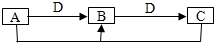
已知A、B、C中均含有同种元素.
(1)若D为金属单质,且以上反应均为氧化还原反应,请写出B→C反应的离子方程式:______.
(2)若D为碱,且以上反应均为非氧化还原反应,则A、B、C、D分别可以是:(按顺序写出合理的一组物质的化学式即可)A是______;B是______;C是______;D是______.
(1)已知A、B、C中均含有同种元素,若D为金属单质,则可以是锌,A可以是FeCl3,锌适量时,Zn+2FeCl3=ZnCl2+2FeCl2;锌过量时,Zn+FeCl2=ZnCl2+Fe,且Fe+2FeCl3=3FeCl2符合题意,所以B为FeCl2,C为Fe,B→C反应的离子方程式为:Zn+Fe2+=Fe+Zn2+;或D为Fe,A为Cl2,B为FeCl3,C为FeCl2,故B→C反应的离子方程式为:2Fe3++Fe=3Fe2+;
故答案为:Zn+Fe2+=Fe+Zn2+;或2Fe3++Fe=3Fe2+;
(2)若D为碱,且以上反应均为非氧化还原反应,所以与碱能发生连续反应的最典型的物质是Al3+,A和C反应是氯化铝和偏铝酸钠反应生成氢氧化铝沉淀,所以反应的离子方程式为:Al3++3AlO2-+6H2O=4Al(OH)3↓;则A可以是AlCl3,B是Al(OH)3,C是NaAlO2,D为NaOH;
故答案为:AlCl3;Al(OH)3;NaAlO2;NaOH.
分析:A、B、C中均含有同一种元素,且ABC和同种物质连续发生反应,化学上能实现此转化的物质较多,可以是氧化还原反应,也可以是酸碱反应,最主要的是A和C能生成B的转化分析和判断;
若D为金属,则ABC 中的元素化合价要变化,实现转化是氧化还原反应;变价金属典型的是铁元素,转化关系只能是Fe3+→Fe2+→Fe,能实现三价铁离子变为二价铁离子的金属,并且能从二价铁盐溶液中置换出金属铁的金属只有锌,所以判断D为锌;若D为碱,反应均为非氧化还原反应,元素化合物中能与强碱连续反应的典型物质是铝及其化合物的性质,即Al3+→Al(OH)3→AlO2-;符合题中的转化关系,结合物质的性质分析解答.
点评:本题考查了元素化合物的化学性质的应用,特别是能和一种物质发生连续反应的实质,连续反应的特征和转化关系中A+B→C的转化判断是解决本题的关键,综合性较强,需要熟练掌握元素化合物的有关知识.

 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案工业上合成氨是在一定条件下进行如下反应:
N2(g)+3H2(g)![]() 2NH3(g),△H=-92.2kJ/mol;其部分工艺流程如下:
2NH3(g),△H=-92.2kJ/mol;其部分工艺流程如下:

反应体系中各组分的部分性质见下表:
| 气体 | 氮气 | 氢气 | 氨 |
| 熔点(℃) | -210.01 | -252.77 | -77.74 |
| 沸点(℃) | -195.79 | -259.23 | -33.42 |
回答下列问题:
(1)写出该反应的化学平衡常数表达式:K= 。随着温度升高,
K值 (填增大、减小、不变)。
(2)平衡常数K值越大,表明 (填序号)。
A.N2的转化率越高 B.NH3的产率越大
C.原料中N2的含量越高 D.化学反应速率越快
(3)合成氨反应的平衡常数很小,所以在工业上采取气体循环的流程。即反应后通过把混合气体的温度降低到 使 分离出来;继续循环的气体是 。
工业上合成氨是在一定条件下进行如下反应:
N2(g)+3H2(g)2NH3(g),△H=-92.2kJ/mol;其部分工艺流程如下:
反应体系中各组分的部分性质见下表:
| 气体 | 氮气 | 氢气 | 氨 |
| 熔点(℃) | -210.01 | -252.77 | -77.74 |
| 沸点(℃) | -195.79 | -259.23 | -33.42 |
回答下列问题:
(1)写出该反应的化学平衡常数表达式:K= 。随着温度升高,
K值 (填增大、减小、不变)。
(2)平衡常数K值越大,表明 (填序号)。
A.N2的转化率越高 B.NH3的产率越大
C.原料中N2的含量越高 D.化学反应速率越快
(3)合成氨反应的平衡常数很小,所以在工业上采取气体循环的流程。即反应后通过把混合气体的温度降低到 使 分离出来;继续循环的气体是 。
(14分)工业上利用CO和水蒸气在一定条件下发生反应制取氢气:
CO(g)+H2O(g)  CO2(g)+H2(g)
CO2(g)+H2(g)
某研究小组分别在体积均为2 L的恒容密闭容器中加入一定量的反应物,使其发生反应,相关数据如下:
|
容器 编号 |
温度 /℃ |
起始量/mol |
平衡量/mol |
达到平衡的时间/min |
达平衡时体系能量的变化/kJ |
||
|
CO |
H2O |
CO2 |
H2 |
||||
|
① |
650 |
1 |
2 |
0.4 |
0.4 |
5 |
16.4kJ |
|
② |
650 |
2 |
4 |
|
|
t1 |
Q1 kJ |
|
③ |
900 |
2 |
4 |
1.6 |
1.6 |
t2 |
Q2 kJ |
(1)计算容器②中反应的平衡常数K= (计算结果保留两位小数)。
(2)容器③中反应达平衡时,CO的转化率为 。
(3)容器①中反应达平衡这段时间,化学反应速率v (H2) = 。
(4)该反应的正反应为 (填“吸热”或“放热”)反应,理由是 。
(5)下列叙述正确的是 (填字母序号)。
a.平衡时,容器①和容器②中CO2的体积分数相等
b.反应达平衡状态时,Q2 > Q1 > 32.8 kJ
c.达到平衡的时间:t2 > t1>2.5 min
d.该反应的热化学方程式可表示为:CO(g)+H2O(g)  CO2(g)+H2(g) △H=-41 kJ/mol
CO2(g)+H2(g) △H=-41 kJ/mol
(6)容器②中反应进行到t min时,测得混合气体中CO2的物质的量为0.6 mol。若用200 mL 5 mol/L的NaOH溶液将其完全吸收,得到的溶液中所有离子的物质的量浓度由大到小的顺序为 。