题目内容
KClO3和浓HCl在一定温度下反应会生成黄绿色的易爆物二氧化氯。其反应可表述为:
KClO3+ HCl(浓)= KCl+ ClO2+ Cl2+ H2O
(1)配平以上化学方程式(化学计量数填入划线上)并用双线桥标出电子转移的方向和数目。
(2)反应中的氧化剂是 , ClO2是反应的 (填氧化或还原)产物。
(3)反应产生0.1 mol Cl2,则转移的电子的物质的量为 mol。
(4)ClO2具有很强的氧化性,因此可被用来做消毒剂,若ClO2作消毒剂后其自身转化为Cl-,则其消毒的效率(以单位物质的量得到电子数表示)是Cl2的 倍。
(1)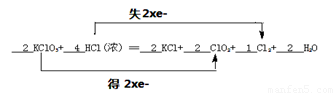 (2分)
(2分)
(2)KClO3 (1分) 还原 (1分) (3)0.2mol (1分) (4)2.5倍 (1分)
【解析】
试题分析:(1)KClO3中氯元素化合价由+5价降低为ClO2中+4价,得到1个电子,氯酸钾是氧化剂;HCl中氯元素化合价由-1价升高为Cl2中0价,失去1个电子,氯化氢是还原剂。根据电子得失守恒可知,氧化剂与还原剂的物质的量之比是1:1。因此KClO3系数为2,ClO2系数为2,KCl系数为2。Cl2系数为1,则HCl系数为4,结合原子守恒可知水的系数是2。因此该反应电子转移的方向和数目可表示为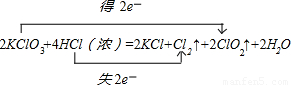 。
。
(2)反应2KClO3+4HCl(浓)=2KCl+Cl2↑+2ClO2↑+2H2O中,由KClO3中氯元素化合价由+1价降低为ClO2中+4价可知,KClO3中氯元素被还原,所以KClO3是氧化剂,ClO2是还原产物。
(3)反应中只有Cl2是氧化产物,HCl中氯元素化合价由-1价升高为Cl2中0价,所以产生0.1molCl2转移的电子的物质的量为0.1mol×2=0.2mol。
(4)1molCl2可以获得2mol电子,ClO2作消毒剂后其自身转化为Cl-,这说明1molClO2可以获得5mol电子,所以ClO2消毒的效率是Cl2的 =2.5倍。
=2.5倍。
考点:考查氧化还原反应方程式的配平、氧化剂、还原产物的判断以及有关计算

 阅读快车系列答案
阅读快车系列答案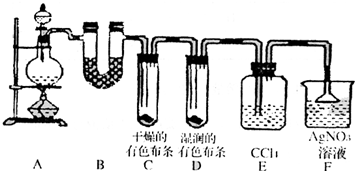 某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如下图所示的实验装置(支撑用的铁架台省略),按要求回答问题.
某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,甲同学设计了如下图所示的实验装置(支撑用的铁架台省略),按要求回答问题.