��Ŀ����
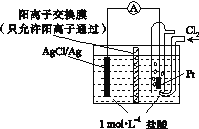
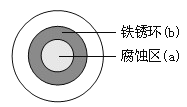
����Ŀ����NaCl��Һ����һ�����������������ϣ�һ��ʱ�����Һ�θ��ǵ�Բ��������(a)�ѱ���ʴ���䰵����Һ�������γ���ɫ���(b)����ͼ��ʾ�����¸��������Ҫԭ����Һ��֮�����������ȱ�Ե�١�����˵����ȷ������ ��
A. Һ���е�Cl�D��a����b��Ǩ��
B. Һ�α�Ե���������������ĵ缫��ӦΪ��O2��2H2O��4e��=4OH��
C. Һ���µ�Fe������ԭ��Ӧ������ʴ�����ɵ�Fe2����a����b��Ǩ�ƣ���b����OH�D�γ�Fe(OH)2����һ����������ˮ�γ�����
D. ������Ƕ��һͭ��˿�������壬��ͭ���Ӵ����μ�NaCl��Һ���������ĵ缫��ӦΪ��Cu��2e��=Cu2��
���𰸡�B
�����������������A��������ԭ����У����������������������������Ĺ��ɣ�������Cl-Ӧ��b����a��Ǩ�ƣ�����B��O2��Һ�����ط�Ӧ�������缫��ӦΪ��O2+2H2O+4e-=4OH-��������ԭ��Ӧ����ȷ��C��Һ���µ�Fe����������Ӧ������ʴ������D��������Ƕ��һͭ��˿�������壬��ͭ���Ӵ����μ�NaCl��Һ������Fe�Ľ�����Ա�ͭǿ��Fe��Ϊ���������������ĵ缫��ӦΪ��Fe-2 e-=Fe2+������

��ϰ��ϵ�д�
�����Ŀ