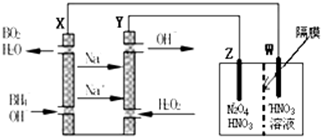
题目内容
9.有机物PAS-Na是一种治疗肺结核药物的有效成分,有机物G是一种食用香料,以甲苯为原料合成这两种物质的路线如下: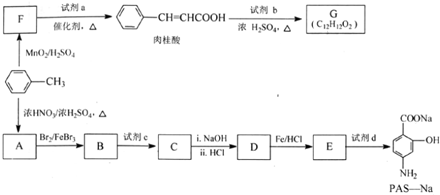
已知:
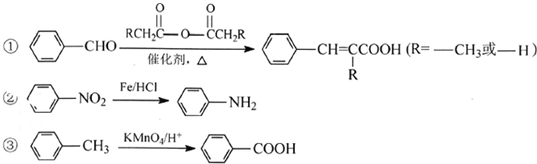
完成下列填空:
(1)由A 生成B 的化学方程式为
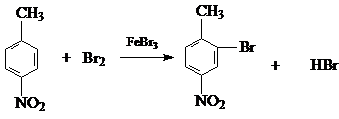 .
. (2)C与NaOH反应的化学方程式是
 .
. (3)F中含氧官能团的名称是醛基;试剂a的结构简式为H3COOOCCH3.
(4)试剂b的相对分子质量为58,分子中不含甲基,且为链状结构,肉挂酸与试剂b生成G的化学方程式为
(5)肉桂酸有多种同分异构体,符合下列条件:a.苯环上有三个取代基;b.能发生银镜反应,且1mol该有机物最多生成4molAg.由上述符合条件的同分异构体中,写出苯环上有两种不同化学环境氢原子的有机物的结构简式
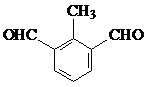 、
、 .
.
分析 由反应的流程可看出:根据信息② 在MnO2/H2SO4条件下氧化为F
在MnO2/H2SO4条件下氧化为F ,
, 和H3COOOCCH3反应得
和H3COOOCCH3反应得 ,
, 和丙烯醇酯化得G;
和丙烯醇酯化得G; 和浓硝酸发生硝化反应生成A,结构简式为
和浓硝酸发生硝化反应生成A,结构简式为 ,
, 和Br2卤化在甲基邻位引入Br得B,B被酸性高锰酸钾氧化,将甲基氧化为羧基得C,C碱性条件下水解后,再酸化得D,D中硝基被还原为氨基得E,E和碳酸氢钠反应得PAS-Na,据此分析解答.
和Br2卤化在甲基邻位引入Br得B,B被酸性高锰酸钾氧化,将甲基氧化为羧基得C,C碱性条件下水解后,再酸化得D,D中硝基被还原为氨基得E,E和碳酸氢钠反应得PAS-Na,据此分析解答.
解答 解:由反应的流程可看出:根据信息② 在MnO2/H2SO4条件下氧化为F
在MnO2/H2SO4条件下氧化为F ,
, 和H3COOOCCH3反应得
和H3COOOCCH3反应得 ,
, 和丙烯醇酯化得G;
和丙烯醇酯化得G; 和浓硝酸发生硝化反应生成A,结构简式为
和浓硝酸发生硝化反应生成A,结构简式为 ,
, 和Br2卤化在甲基邻位引入Br得B,B被酸性高锰酸钾氧化,将甲基氧化为羧基得C,C碱性条件下水解后,再酸化得D,D中硝基被还原为氨基得E,E和碳酸氢钠反应得PAS-Na,
和Br2卤化在甲基邻位引入Br得B,B被酸性高锰酸钾氧化,将甲基氧化为羧基得C,C碱性条件下水解后,再酸化得D,D中硝基被还原为氨基得E,E和碳酸氢钠反应得PAS-Na,
(1)A和Br2取代发生生成B的方程式是: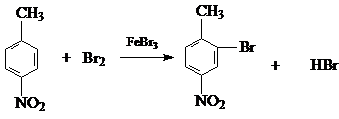
故答案为: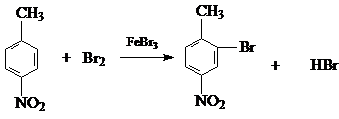
(2)根据以上分析,C中含有羧基和溴原子,所以和氢氧化钠溶液水解、中和的方程式为:
故答案为:
(3)由新信息及流程推断,F为 ,其中一定含有醛基,F生成肉桂醛根据信息②,则试剂a是乙酸酐,结构简式为CH3COOOCCH3,
,其中一定含有醛基,F生成肉桂醛根据信息②,则试剂a是乙酸酐,结构简式为CH3COOOCCH3,
故答案为:醛基;H3COOOCCH3;
(4)试剂b的相对分子质量为58,分子中不含甲基,且为链状结构可推知,是丙烯醇,即CH2=CHCH2OH,则方程式为:,
故答案为:;
(5)肉桂酸的同分异构体,能发生银镜反应,且1mol该有机物最多生成4mol Ag,说明含有2个醛基,又苯环上有三个取代基,所以连有两个醛基和一个甲基,由三个基团的相对位置不同,这样的同分异构体应有6种;
苯环上有两种等效氢的有两种,即 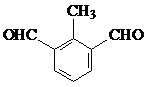

故答案为: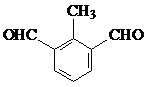

点评 本题考查有机物合成及结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,注意合成流程中官能团及结构的变化,侧重分析能力及知识迁移能力的考查,(5)中同分异构体的判断解答的难点,题目难度不大.

| A. | 检查装置的气密性--制取气体、验证气体的性质等与气体有关的实验操作 | |
| B. | 检查是否漏水--滴定管、容量瓶、分液漏斗等的使用 | |
| C. | 验纯--点燃可燃性气体 | |
| D. | 湿润--用石蕊试纸、碘化钾淀粉试纸和pH 试纸检验或验证某些气体 |
| 若电解质 | H2CO3 | NH3•H2O |
| 电离平衡常数(25℃) | ${K}_{{a}_{1}}$=4.30×107 ${K}_{{a}_{2}}$=5.61×10-11 | Kh=1.77×10-5 |
常数Kh=$\frac{{K}_{w}}{{K}_{{a}_{2}}}$.下列说法正确的是.
| A. | 由数据可判断该溶液呈酸性 | |
| B. | c(NH4+)>c(HCO32-)>c(CO32-)>c(NH3•H2O) | |
| C. | c(NH4+)+c(NH3•H2O)=2c(CO32-)+2c(HCO3-)+2c(H2CO3) | |
| D. | c(NH4+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-) |
| A. | 液氯、干冰均为纯净物 | |
| B. | NO2、CO、CO2均为酸性氧化物 | |
| C. |  与 与 互为同系物 互为同系物 | |
| D. | 淀粉、纤维素和油脂都属于天然高分子化合物 |
| A. | 属于羧基类的有2种 | |
| B. | 属于酯类的有3种 | |
| C. | 存在分子中含有六元环的同分异构体 | |
| D. | 分子中可含有两种不同的官能团 |
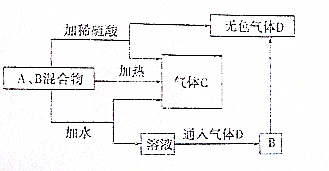 有A、B两种常见化合物,其焰色反应均呈黄色,C是一种单质气体,相互转化关系如图所示(其他物质均已略去)回答下列问题:
有A、B两种常见化合物,其焰色反应均呈黄色,C是一种单质气体,相互转化关系如图所示(其他物质均已略去)回答下列问题: 向Fe(OH)3胶体中滴入硫酸直到过量,描述此过程的实验现象_______________________。
向Fe(OH)3胶体中滴入硫酸直到过量,描述此过程的实验现象_______________________。