题目内容
【题目】将N2和H2置于2L密闭容器中,反应2min后,生成0.8molNH3 . 在这段时间内,用N2浓度变化表示的反应速率为( )
A.0.05molL﹣1min﹣1
B.0.1molL﹣1min﹣1
C.0.2molL﹣1min﹣1
D.0.4molL﹣1min﹣1
【答案】B
【解析】解:氮气与氢气反应:N2+3H22NH3 . 2min内,生成0.8molNH3 , 所以v(NH3)= ![]() =0.2mol/(Lmin),
=0.2mol/(Lmin),
由化学速率之比等于化学计量数之比,所以v(N2)=0.5v(NH3)=0.5×0.2mol/(Lmin)=0.1mol/(Lmin).
故选B.
【考点精析】通过灵活运用反应速率的定量表示方法,掌握反应速率的单位:mol/(L·min)或mol/(L·s) v=△c-△t即可以解答此题.

 阅读快车系列答案
阅读快车系列答案【题目】某硫酸工业废渣的主要成分为SiO2、MgO、Al2O3、Fe2O3等。回收废渣中金属元素的工艺流程如下:
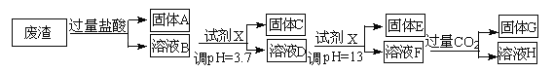
已知常温条件下:
①阳离子以氢氧化物形式开始沉淀和恰好完全沉淀(阳离子浓度等于10-5mol·L-1 )时的pH 如下表所
示。
阳离子 | Fe3+ | Al3+ | Mg2+ |
开始沉淀时的pH | 1.9 | 3.7 | 9.6 |
恰好完全沉淀时的pH | 3.2 | 5.2 | 11.0 |
②饱和氨水溶液中c(OH-)约为1×10-3mol·L-1。
请回答下列问题:
(1)固体C为_________(填化学式)。
(2)上述流程中两次使用试剂X,试剂X是_________(填“氨水”或“氢氧化钠”),其理由是_________________。
(3)溶液D→固体E的过程中需要控制溶液pH=13,如果pH过小,可能导致的后果是________________。
(4)写出溶液F→溶液H 的离子方程式:__________________。
(5)Ksp[Mg (OH )2]=_____________。
【题目】煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程.
(1)将水蒸气通过红热的碳即可产生水煤气.反应为:C(s)+H2O(g)CO(g)+H2(g)△H=+131.3kJmol﹣1 , △S=+133.7J(Kmol)﹣1
①该反应能否自发进行与有关;
②一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是(填字母,下同).
a.容器中的压强不变 b.1molH﹣H键断裂的同时断裂2molH﹣O键
c.v正(CO)=v逆(H2O) d.c(CO)=c(H2)
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g)CO2(g)+H2(g),得到如下三组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
H2O | CO | H2 | CO | |||
1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
3 | 900 | a | b | c | d | t |
①实验1中以v(CO2) 表示的反应速率为 .
②该反应的逆反应为(填“吸”或“放”)热反应
③若实验3要达到与实验2相同的平衡状态(即各物质的质量分数分别相等),且t<3min,则a、b应满足的关系是(用含a、b的数学式表示).
(3)目前工业上有一种方法是用CO2来生产甲醇.一定条件下发生反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g),图表示该反应进行过程中能量(单位为kJmol﹣1)的变化.在体积为1L的恒容密闭容器中,充入1mol CO2和3mol H2 , 下列措施中能使c (CH3OH)增大的是 .
a.升高温度 b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离出来 d.再充入1mol CO2和3molH2 . 


