题目内容
3.我国是个钢铁大国,钢铁产量为世界第一,高炉炼铁是最为普遍的炼铁方法.I.已知反应 $\frac{1}{3}$Fe2O3(s)+CO(g)?$\frac{2}{3}$Fe(s)+CO2(g)△H=-23.5kJ•mol-1,该反应在
1000℃的平衡常数等于4.在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0mol,反应经过l0min后达到平衡.
(1)CO的平衡转化率=60%
(2)欲提高CO的平衡转化率,促进Fe2O3的转化,可采取的措施是d
a.提高反应温度 b.增大反应体系的压强 c.选取合适的催化剂
d.及时吸收或移出部分CO2e.粉碎矿石,使其与平衡混合气体充分接触
Ⅱ.高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下和H2反应制备甲醇:CO(g)+2H2(g)?CH3OH(g).请根据图示回答下列问题:

(3)从反应开始到平衡,用H2浓度变化表示平均反应速率v(H2)=0.15mol/(L•min)
(4)已知氢气的燃烧热286KJ/mol,请写出甲醇气体不充分燃烧的热化学方程式CH3OH(g)+O2(g)=2H2O(l)+CO(g)△H=-481kJ/mol.
(5)若在温度和容器相同的三个密闭容器中,按不同方式投入反应物,测得反应达到平衡吋的有关数据如下表:
| 容器 | 反应物投入的量 | 反应物的 转化率 | CH3OH的浓度 | 能量变化 (Q1、Q2、Q3均大于0) |
| 甲 | 1mol CO和2mol H2 | α1 | c1 | 放出Q1kJ热量 |
| 乙 | 1mol CH3OH | α2 | c2 | 吸收Q2kJ热量 |
| 丙 | 2mol CO和4mol H2 | α3 | c3 | 放出Q3kJ热量 |
A.c1=c2B.2Q1=Q3C.2α1=α3D.α1+α2=1
E.该反应若生成1mol CH3OH,则放出(Q1+Q2)kJ热量.
分析 I.(1)令平衡时CO的物质的量变化为nmol,表示出平衡时CO、CO2的物质的量,化学计量数都是1,利用物质的量代替浓度代入平衡常数计算n的值,再利用转化率定义计算CO的转化率;
(2)a.该反应正反应是放热反应,提高反应温度,平衡向逆反应移动;
b.反应前后气体的物质的量不变,增大压强平衡不移动;
c.加入合适的催化剂,平衡不移动;
d.移出部分CO2,平衡向正反应移动;
e.粉碎矿石,使其与平衡混合气体充分接触,平衡不移动;
Ⅱ(3)根据v=$\frac{△c}{△t}$计算v(CH3OH),再利用速率之比等于化学计量数之比计算v(H2);
(4)氢气的燃烧热为286kJ/mol,则:2H2(g)+O2(g)=2H2O(l)△H=-572kJ/mol ①,
由图可得:CO(g)+2H2(g)?CH3OH(g)△H=-91kJ/mol ②,
根据盖斯定律,①-②可得:CH3OH(g)+O2(g)=2H2O(l)+CO(g);
(5)A.甲、乙是完全等效平衡,平衡时各组分的浓度相等;
B.丙与甲相比,等效为在甲平衡的基础上再加入1mol CO和2mol H2,压强增大,平衡向正反应方向移动,丙中反应物的转化率大于甲;
C.丙与甲相比,等效为在甲平衡的基础上再加入1mol CO和2mol H2,压强增大,平衡向正反应方向移动,转化率增大,但2α1不一定等于α3 ;
D.CO的转化率为α1,则平衡时CO的物质的量为(1-α1)mol,乙中平衡时甲醇的转化率为α2,乙中平衡时CO的物质的量为α2mol,甲与乙是完全等效平衡,平衡时对应各组分的含量完全相同;
E.令平衡时CO的物质的量为nmol,CO(g)+2H2(g)?CH3OH(g)的反应热△H=-QkJ/mol,则Q1=(1-n)Q、Q2=nQ,整理得Q=Q1+Q2.
解答 解:I(1)令平衡时CO的物质的量变化为nmol,则:
$\frac{1}{3}$Fe2O3(s)+CO(g)?$\frac{2}{3}$Fe(s)+CO2(g)
开始(mol):1 1
变化(mol):n n
平衡(mol):1-n n+1
所以 $\frac{n+1}{1-n}$=4,解得n=0.6,则CO的平衡转化率为 $\frac{0.6mol}{1mol}$×100%=60%,
故答案为:60%;
(2)a.该反应正反应是放热反应,提高反应温度,平衡向逆反应移动,CO的平衡转化率降低,故a错误;
b.反应前后气体的物质的量不变,增大压强平衡不移动,CO的平衡转化率不变,故b错误;
c.加入合适的催化剂,平衡不移动,故c错误;
d.移出部分CO2,平衡向正反应移动,CO的平衡转化率增大,故d正确;
e.粉碎矿石,使其与平衡混合气体充分接触,可以加快反应速率,但平衡不移动,故e错误;
故答案为:d;
Ⅱ(3)由图可知,达到平衡时甲醇的浓度变化为0.75mol/L,则v(CH3OH)=$\frac{0.75mol/L}{10min}$=0.075mol/(L.min),速率之比等于化学计量数之比,v(H2)=2v(CH3OH)=0.15mol/(L•min),
故答案为:0.15mol/(L•min);
(4)氢气的燃烧热为286kJ/mol,则:2H2(g)+O2(g)=2H2O(l)△H=-572kJ/mol ①,
由图可得:CO(g)+2H2(g)?CH3OH(g)△H=-91kJ/mol ②,
根据盖斯定律,①-②可得:CH3OH(g)+O2(g)=2H2O(l)+CO(g),
则甲醇气体不充分燃烧的热化学方程式:CH3OH(g)+O2(g)=2H2O(l)+CO(g)△H=-481kJ/mol,
故答案为:CH3OH(g)+O2(g)=2H2O(l)+CO(g)△H=-481kJ/mol;
(5)A.甲、乙是完全等效平衡,平衡时各组分的浓度相等,所以平衡时甲醇的浓度c1=c2,故A正确;
B.丙与甲相比,等效为在甲平衡的基础上再加入1mol CO和2mol H2,压强增大,平衡向正反应方向移动,丙中反应物的转化率大于甲,丙中参加反应的CO大于甲中的2倍,故2Q1<Q3,故B错误;
C.丙与甲相比,等效为在甲平衡的基础上再加入1mol CO和2mol H2,压强增大,平衡向正反应方向移动,丙中反应物的转化率大于甲,但2α1不一定等于α3 ,故C错误;
D.甲与乙是完全等效平衡,平衡时对应各组分的含量完全相同,CO的转化率为α1,则平衡时CO的物质的量为(1-α1)mol,乙中平衡时甲醇的转化率为α2,乙中平衡时CO的物质的量为α2mol,故(1-α1)=α2,整理得α1+α2=1,故D正确;
E.令平衡时CO的物质的量为nmol,CO(g)+2H2(g)?CH3OH(g)的反应热△H=-QkJ/mol,则Q1=(1-n)Q、Q2=nQ,整理得Q=Q1+Q2,故1mol CH3OH,则放出(Q1+Q2)kJ热量,故E正确,
故答案为:ADE.
点评 本题综合考查了化学平衡计算、等效平衡等,Ⅱ中等效平衡的计算,为该题的难点,也是易错点,注意理解等效平衡问题,思维量大,难度中等.

| A. | 在反应Cl2+2NaOH═NaCl+NaClO+H2O中,Cl2是氧化剂,NaOH是还原剂 | |
| B. | 在反应MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O中,HCl是氧化剂,MnO2是还原剂 | |
| C. | 在反应NaH+H2O═NaOH+H2↑中,H2既是氧化物又是还原产物 | |
| D. | 在反应H2S+H2SO4═S↓+SO2↑+2H2O中SO2是氧化产物,S是还原产物 |

已知,浸出液的pH<2,其中的金属离子主要是Mn2+,还含有少量的Fe2+、Al3+等其他金属离子.有关金属离子形成氢氧化物沉淀时的pH见表:
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 7.6 | 9.7 |
| Fe3+ | 2.7 | 3.7 |
| Al3+ | 3.8 | 4.7 |
| Mn2+ | 8.3 | 9.8 |
(1)高温焙烧:在实验室宜选择的主要仪器是坩埚.
(2)写出氧化过程中主要反应的离子方程式:2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O.
(3)在氧化后的液体中加入石灰浆,并调节溶液pH,pH应调节的范围是4.7≤pH<8.3.
(4)滤渣的主要成分有硫酸钙、氢氧化铁、氢氧化铝.
(5)工业生产中为了确定需要向浸出液中加入多少MnO2粉,可准确量取10.00mL浸出液用0.02mol/L酸性KMnO4溶液滴定,判断滴定终点的方法是当滴入最后一滴酸性KMnO4溶液,溶液变紫红色,且半分钟内不褪色.若达滴定终点共消耗10.00mL酸性KMnO4溶液,请计算浸出液中Fe2+浓度是0.1mol/L.
| A. | 等于10mL | B. | 小于10mL | C. | 大于10mL | D. | 等于5mL |
| A. | 次氯酸的结构式:H-Cl-O | B. | 中子数为1的氢原子:${\;}_{1}^{1}$H | ||
| C. | 甲基的电子式: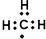 | D. | CO2的比例模型: |
 +H2O2
+H2O2 +H2O
+H2O
