题目内容
一定量的氢气在氯气中燃烧,所得混合物用100ml 3.00mol/L的NaOH溶液恰好完全吸收,测得溶液中含有NaClO的物质的量为0.05 mol。
(1)所得溶液中Cl-的物质的量为 mol。
(2)参加反应的氢气在标准状况下的体积是 L。(写出计算过程,下同)
(3)所用氯气和参加反应的氢气的物质的量之比为 。
(1)所得溶液中Cl-的物质的量为 mol。
(2)参加反应的氢气在标准状况下的体积是 L。(写出计算过程,下同)
(3)所用氯气和参加反应的氢气的物质的量之比为 。
(1)0.25 (2)2.24 (3)3:2
试题分析:(1)
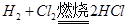

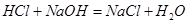
所以0.1L*3.00mol/L=0.3mol的
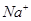 一部分与
一部分与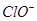 结合为NaClO,一部分与Cl-结合为
结合为NaClO,一部分与Cl-结合为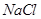 ,因为NaClO的物质的量为0.05 mol,故0.3-0.05=0.25mol
,因为NaClO的物质的量为0.05 mol,故0.3-0.05=0.25mol(2)因为NaClO的物质的量为0.05 mol,根据化学方程式可得有0.05mol的
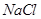 ,因为一共有0.25mol的
,因为一共有0.25mol的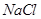 ,所以有0.2mol的
,所以有0.2mol的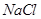 是由
是由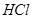 和
和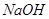 生成的。根据化学方程式,可知有0.1mol的
生成的。根据化学方程式,可知有0.1mol的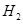 和
和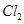 发生反应,0.1mol的
发生反应,0.1mol的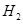 在标准状况下的体积是2.24L。
在标准状况下的体积是2.24L。(3)因为NaClO的物质的量为0.05 mol,所以参与反应
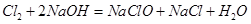 的
的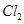 为0.05mol,根据上题可知有0.1mol的
为0.05mol,根据上题可知有0.1mol的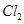 参与反应
参与反应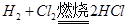 ,所以一共有0.15mol的
,所以一共有0.15mol的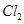 ,0.1mol的
,0.1mol的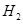 ,所以所用氯气和参加反应的氢气的物质的量之比为0.15:0.1=3:2
,所以所用氯气和参加反应的氢气的物质的量之比为0.15:0.1=3:2
练习册系列答案
相关题目
