题目内容
【题目】已知100 kPa、298.15 K时氢氟酸的电离过程HF(aq)H+(aq)+F-(aq) ΔH=-12.5kJ·mol-1,ΔS=-102.5 J·mol-1·K-1,试判断该过程的自发性( )
A. 可自发进行 B. 不能自发进行 C. 达到平衡 D. 不能判定
【答案】B
【解析】
化学反应能否自发进行,取决于焓变和熵变的综合判据,当△G=△H-T△S<0时,反应能自发进行。
由题给数据可得△H-T△S=-12.5KJ/mol-[-0.1025KJ/(molK)×298.15K] ≈18.1>0,该过程为非自发过程,故选B。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】研究+6价铬盐不同条件下微粒存在形式及氧化性,某小组同学进行如下实验:
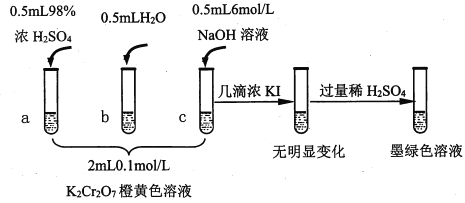
已知:Cr2O72- (橙色)+H2O![]() 2CrO42-(黄色)+2H+ △H= +13.8 kJ/mol,+6价铬盐在一定条件下可被还原为Cr3+,Cr3+在水溶液中为绿色。
2CrO42-(黄色)+2H+ △H= +13.8 kJ/mol,+6价铬盐在一定条件下可被还原为Cr3+,Cr3+在水溶液中为绿色。
(1)试管c和b对比,推测试管c的现象是________。
(2)试管a和b对比,a中溶液橙色加深。甲认为温度也会影响平衡的移动,橙色加深不一定是c(H+)增大影响的结果;乙认为橙色加深一定是c(H+)增大对平衡的影响。你认为是否需要再设计实验证明?____(“是”或“否”),理由是_________________________________。
(3)对比试管a、b、c的实验现象,得到的结论是________________。
(4)试管c继续滴加KI溶液、过量稀H2SO4,分析上图的实验现象,得出的结论是_______;写出此过程中氧化还原反应的离子方程式________________。
(5)小组同学用电解法处理含Cr2O72-废水,探究不同因素对含Cr2O72-废水处理的影响,结果如下表所示(Cr2O72-的起始浓度,体积、电压、电解时间均相同)。
实验 | ⅰ | ⅱ | ⅲ | ⅳ |
是否加入Fe2(SO4)3 | 否 | 否 | 加入5g | 否 |
是否加入H2SO4 | 否 | 加入1mL | 加入1mL | 加入1mL |
电极材料 | 阴、阳极均为石墨 | 阴、阳极均为石墨 | 阴、阳极均为石墨 | 阴极为石墨,阳极为铁 |
Cr2O72-的去除率/% | 0.922 | 12.7 | 20.8 | 57.3 |
①实验ⅱ中Cr2O72-放电的电极反应式是________________。
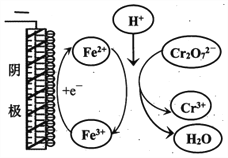
②实验ⅲ中Fe3+去除Cr2O72-的机理如图所示,结合此机理,解释实验iv中Cr2O72-去除率提高较多的原因_______________。