题目内容
【题目】氯化铁和高铁酸钾都是常见的水处理剂,下图为制备粗高铁酸钾的工业流程。
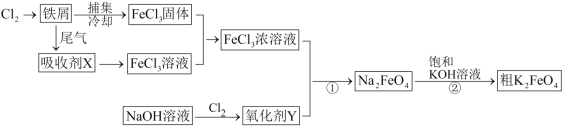
请回答下列问题:
(1)氯化铁做净水剂的原因是(结合化学用语表达) 。
(2)吸收剂X的化学式为 ,氧化剂Y的化学式为 。
(3)碱性条件下反应①的离子方程式为 。
(4)过程②将混合溶液搅拌半小时,静置,抽滤获得粗产品。该反应的化学方程式为2KOH+NaFeO4=K2FeO4+2NaOH,请根据反应原理分析反应能发生的原因 。
(5)K2FeO4在水溶液中易发生反应:4FeO42-+10H2O=4Fe(OH)3+8OH-+3O2↑。在提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用 (填序号)。
A.H2O B.稀KOH溶液 C.NH4Cl溶液 D.Fe(NO3)3溶液
除了这种洗涤剂外,一般工业生产还要加入异丙醇作为洗涤剂,你认为选择异丙醇的原因是 。
(6)高铁电池是正在研制中的充电电池,具有电压稳定、放电时间长等优点。以高铁酸钾、二氧化硫和三氧化硫为原料,硫酸钾为电解质,用惰性电极设计成能在高温下使用的电池,写出该电池的正极反应式 。
【答案】
(1)Fe3+ +3H2O![]() Fe(OH)3+3H+;水解产生的Fe(OH)3胶体能够吸附杂质;
Fe(OH)3+3H+;水解产生的Fe(OH)3胶体能够吸附杂质;
(2)FeCl2;NaClO
(3)2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O
(4)K2FeO4溶解度小于NaFeO4,析出晶体,促进反应进行
(5)B;高铁酸钾在异丙醇中的溶解度小于在水中的溶解度,用异丙醇洗涤有利于提高产品回收率
(6)FeO42- + 3e- + 4SO3 = Fe3+ + 4SO42-
【解析】
试题分析:(1)氯化铁水解生成的氢氧化铁胶体具有吸附性,能够吸附杂质可做净水剂,故答案为:Fe3+ +3H2O![]() Fe(OH)3+3H+;水解产生的Fe(OH)3胶体能够吸附杂质;
Fe(OH)3+3H+;水解产生的Fe(OH)3胶体能够吸附杂质;
(2)根据流程图,吸收剂X吸收氯气后能够生成氯化铁,因此X为氯化亚铁,氢氧化钠与氯气反应生成氧化剂Y,因此氧化剂Y为次氯酸钠,故答案为:FeCl2;NaClO;
(3)碱性条件下,氯化铁与次氯酸钠反应生成高铁酸钠,因此反应①的离子方程式为2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O,故答案为:2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O;
(4)由于K2FeO4溶解度小于NaFeO4,析出晶体,促进2KOH+NaFeO4=K2FeO4+2NaOH反应进行,故答案为:K2FeO4溶解度小于NaFeO4,析出晶体,促进反应进行;
(5)由于4FeO42-+10H2O=4Fe(OH)3+8OH-+3O2↑。在提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,洗涤剂最好选用碱性溶液,故选B;除了氢氧化钠外,一般工业生产还要加入异丙醇作为洗涤剂,是因为高铁酸钾在异丙醇中的溶解度小于在水中的溶解度,用异丙醇洗涤有利于提高产品回收率,故答案为:B;高铁酸钾在异丙醇中的溶解度小于在水中的溶解度,用异丙醇洗涤有利于提高产品回收率;
(6)高铁酸钾具有氧化性,在设计的电池中发生还原反应,二氧化硫具有还原性,能够发生氧化反应,生成三氧化硫,因此电池的正极反应式为FeO42- + 3e- + 4SO3 = Fe3+ + 4SO42-,故答案为:FeO42- + 3e- + 4SO3 = Fe3+ + 4SO42-。

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案【题目】利用如图所示装置进行下列实验,能得出相应实验结论的是
选项 | ① | ② | ③ | 实验结论 |
|
A | 浓盐酸 | Na2CO3 | Na2SiO3溶液 | 非金属性: C>Si | |
B | 食盐水 | 电石 | 溴水 | 乙炔可与溴发生加成反应 | |
C | 浓硝酸 | Al | NaOH溶液 | 铝和浓硝酸反应可生成NO2 | |
D | 浓硫酸 | Na2SO3 | KMnO4酸性溶液 | SO2具有还原性 |
A. A B. B C. C D. D