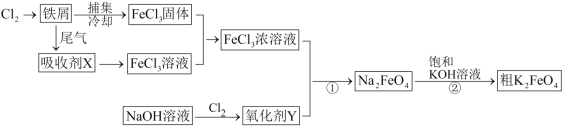
题目内容
【题目】室温下,pH均为2的两种一元酸HA和HB各1mL,分别加水稀释,pH随溶液体积的变化曲线如下图所示:
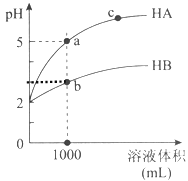
(1)HB溶液体积稀释到1000毫升时,溶液中c(H+)= mol/L。
(2)由图可判断:HA的酸性 (填“>”或“<”)HB的酸性。
(3)pH均为2的一元酸HA和HB各1mL,分别加水稀释后pH不同的原因是什么?请进行完整说明 。
【答案】
(1)10-3;(2)>;
(3)HA为强酸,HA= H++A-,加水稀释时不存在平衡的移动,n(H+)不变,c(H+)减小幅度大,pH增大幅度大;HB为弱酸,存在HB![]() H++B-,加水稀释时,电离程度增大,n(H+)增大,c(H+)减小幅度小,pH增大幅度小;
H++B-,加水稀释时,电离程度增大,n(H+)增大,c(H+)减小幅度小,pH增大幅度小;
【解析】
试题分析:(1)HB溶液体积稀释到1000毫升时,溶液的pH变为3,说明HB为弱酸,溶液中c(H+)=10-3mol/L,故答案为:10-3;
(2)加水稀释相同的倍数,HA的pH变化大于HB,说明酸性HA>HB的酸性,故答案为:>;
(3)根据图像,HA溶液体积稀释到1000毫升时,溶液的pH变为5,说明HA为强酸,HA= H++A-,加水稀释时不存在平衡的移动,n(H+)不变,c(H+)减小幅度大,pH增大幅度大;HB为弱酸,存在HB![]() H++B-,加水稀释时,电离程度增大,n(H+)增大,c(H+)减小幅度小,pH增大幅度小,故答案为:HA为强酸,HA= H++A-,加水稀释时不存在平衡的移动,n(H+)不变,c(H+)减小幅度大,pH增大幅度大;HB为弱酸,存在HB
H++B-,加水稀释时,电离程度增大,n(H+)增大,c(H+)减小幅度小,pH增大幅度小,故答案为:HA为强酸,HA= H++A-,加水稀释时不存在平衡的移动,n(H+)不变,c(H+)减小幅度大,pH增大幅度大;HB为弱酸,存在HB![]() H++B-,加水稀释时,电离程度增大,n(H+)增大,c(H+)减小幅度小,pH增大幅度小。
H++B-,加水稀释时,电离程度增大,n(H+)增大,c(H+)减小幅度小,pH增大幅度小。

练习册系列答案
相关题目