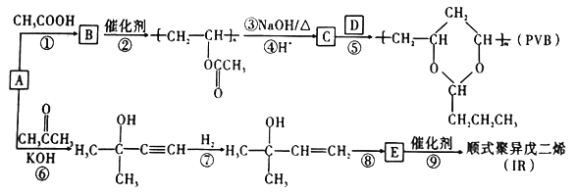
题目内容
【题目】SO2是重要的化工原料,但其造成的环境问题也引起了人们的关注。开发寻找SO2的合理替代品是目前化工行业的新动态。
(1)SO2可以与水反应,反应的化学方程式为____________________________________。SO2是大气的主要污染物,是造成__________________的根源。
(2)工业上常用黄铁矿(FeS2)制备SO2,黄铁矿中S的化合价为____________。黄铁矿煅烧后生成1.6gFe2O3,转移的电子数为________。
(3)工业上使用碱液吸收SO2,使排放的尾气达到合格标准:
①将标准状况下11.2LSO2通入到2L0.5mol·L-1的氨水中,所得溶液中溶质是_________(填化学式)。
②常温下,若用1LNaOH若用吸收0.01molSO2,完全吸收后溶液中c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3),则原NaOH溶液的pH值为________。
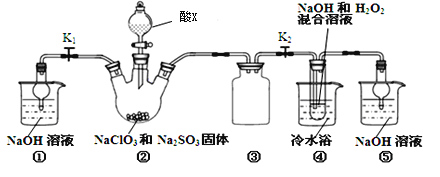
(4)连二亚硫酸钠(Na2S2O4)与SO2相似,具有极强的还原性,可用于保存水果食物。现可用如图所示方法通过吸收SO2和NO,获得Na2S2O4和NH4NO3(Ge为铈元素)

①装置II中,酸性条件下,NO被Ge4+氧化的产物主要是NO3-、NO2-,请写出生成等物质的量的NO3-和NO2-的离子方程式:_______________________________。
②装置III的作用之一是用质子交换膜电解槽电解使得Ge4+再生,同时在另一极生成S2O42-的电极反应式为___________________________。
(5)现今,科学家已研发出比SO2更安全的偏重亚硫酸盐(K2S2O5),工业上常用2KHSO3=K2S2O5+H2O的方法制备。我国要求红酒中添加K2S2O5的标准(按等硫元素质量的SO2计)为0.25g/L。今酿造500吨葡萄酒,需加入K2S2O5的质量为_______。(葡萄酒的密度近似为水,计算结果保留小数点后2位)
【答案】 SO2+H2O![]() H2SO3 酸雨 -1价 0.22NA (NH4)2SO3 12 2NO+3H2O+4Ce4+==NO3-+ NO2-+4 Ce3++6H+ 2H++2HSO3-+2e-=S2O42-+2H2O 2. 17×105g
H2SO3 酸雨 -1价 0.22NA (NH4)2SO3 12 2NO+3H2O+4Ce4+==NO3-+ NO2-+4 Ce3++6H+ 2H++2HSO3-+2e-=S2O42-+2H2O 2. 17×105g
【解析】(1)SO2可以与水反应,反应的化学方程式为SO2+H2O![]() H2SO3。SO2是大气的主要污染物,是造成酸雨的根源。(2)工业上常用黄铁矿(FeS2)制备SO2,黄铁矿中Fe是+2价,因此S的化合价为-1价。黄铁矿煅烧后生成1.6gFe2O3,氧化铁的物质的量是1.6g÷160g/mol=0.01mol,根据原子守恒可知消耗FeS20.02mol。反应中铁从+2价升高到+3价,S从-1价升高到+4价,即FeS2失去11个电子,所以转移的电子物质的量是11×0.02mol=0.22mol,个数为 0.22NA。(3)①将标准状况下11.2LSO2即0.5molSO2通入到2L0.5mol·L-1的氨水即1mol氨水中,二者的物质的量之比是1:2,因此所得溶液中溶质是 (NH4)2SO3。②常温下,若用1LNaOH吸收0.01molSO2,完全吸收后溶液中c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3),根据物料守恒可知氢氧化钠的物质的量是0.01mol,则原NaOH溶液的浓度是0.01mol/L,pH值为12。(4)①装置II中,酸性条件下,NO被Ge4+氧化的产物主要是NO3-、NO2-,根据原子守恒和电子得失守恒可知生成等物质的量的NO3-和NO2-的离子方程式为2NO+3H2O+4Ce4+=NO3-+ NO2-+4Ce3++6H+。②装置III的作用之一是用质子交换膜电解槽电解使得Ge4+再生,该电极是阳极发生失去电子的氧化反应,因此另一极是阴极,发生得到电子的还原反应,则生成S2O42-的电极反应式为2H++2HSO3-+2e-=S2O42-+2H2O。(5)500吨葡萄酒的体积是500000L,设需加入K2S2O5的质量为mg,则500000L×0.25g/L=
H2SO3。SO2是大气的主要污染物,是造成酸雨的根源。(2)工业上常用黄铁矿(FeS2)制备SO2,黄铁矿中Fe是+2价,因此S的化合价为-1价。黄铁矿煅烧后生成1.6gFe2O3,氧化铁的物质的量是1.6g÷160g/mol=0.01mol,根据原子守恒可知消耗FeS20.02mol。反应中铁从+2价升高到+3价,S从-1价升高到+4价,即FeS2失去11个电子,所以转移的电子物质的量是11×0.02mol=0.22mol,个数为 0.22NA。(3)①将标准状况下11.2LSO2即0.5molSO2通入到2L0.5mol·L-1的氨水即1mol氨水中,二者的物质的量之比是1:2,因此所得溶液中溶质是 (NH4)2SO3。②常温下,若用1LNaOH吸收0.01molSO2,完全吸收后溶液中c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3),根据物料守恒可知氢氧化钠的物质的量是0.01mol,则原NaOH溶液的浓度是0.01mol/L,pH值为12。(4)①装置II中,酸性条件下,NO被Ge4+氧化的产物主要是NO3-、NO2-,根据原子守恒和电子得失守恒可知生成等物质的量的NO3-和NO2-的离子方程式为2NO+3H2O+4Ce4+=NO3-+ NO2-+4Ce3++6H+。②装置III的作用之一是用质子交换膜电解槽电解使得Ge4+再生,该电极是阳极发生失去电子的氧化反应,因此另一极是阴极,发生得到电子的还原反应,则生成S2O42-的电极反应式为2H++2HSO3-+2e-=S2O42-+2H2O。(5)500吨葡萄酒的体积是500000L,设需加入K2S2O5的质量为mg,则500000L×0.25g/L= 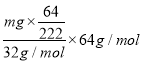 ,解得m=2. 17×105。
,解得m=2. 17×105。

 阅读快车系列答案
阅读快车系列答案