题目内容
在一定温度下,把2体积N2和6体积H2通入一个带活塞的体积可变的容器中,活塞的一端与大气相通(如图9-14)。容器中发生以下反应:N2+3H2![]() 2NH3;ΔH<0。若反应达平衡后,测得混合气体为7体积。据此完成下列问题:?
2NH3;ΔH<0。若反应达平衡后,测得混合气体为7体积。据此完成下列问题:?

图9-14
(1)保持上述反应温度不变,设a、b、c分别代表起始加入的N2、H2和NH3的体积。如果反应达平衡后混合气体中各物质的百分含量仍与上述平衡时完全相同,那么:?
①若a=1、c=2,则b= 。在此情况下,反应起始时将向 (填“正”或“逆”)方向进行。?
②若需规定起始时反应向逆方向进行,则c的范围是? ?。?
(2)在上述装置中,若需控制平衡后,混合气体为6.5体积,则可采取的措施是 ,其原因是 。?
(1)①3 逆 ②1<c≤4?
(2)降低温度 反应向放热(正)反应方向进行,气体体积缩小?
解析:(1)①在同温、同压下,当起始时N2为1体积,NH3为2体积时,为保持与原平衡状态完全相同,可将2体积NH3当作完全分解成1体积N2和3体积H2。因为原来已有1体积N2,此时共有2体积N2。为使H2达到6体积,原来应有3体积H2。即b=3。由于现在平衡与原平衡全等,对比原平衡的平衡C的量可知:当a=1,b=3、c=2时,起始时v(逆)>v(正),反应向逆反应方向进行。??
②若规定起始时反应向逆方向进行,可将2体积N2和6体积H2当作完全化合成4体积NH3,即只有4体积NH3时,起始时只有逆反应发生且反应速率最快;若2体积N2和6体积H2反应生成NH3的反应已达到平衡,在此过程中,v(逆)由最小逐渐增大到与v(正)相等。要使起始时反应向逆反应方向进行,c![]() (NH3)必大于c
(NH3)必大于c![]() (NH3)。设消耗N2为x体积,则:?
(NH3)。设消耗N2为x体积,则:?
N2 + 3H2![]() 2NH3?
2NH3?
起始 2 6 0?
平衡 2-x 6-3x 2x?
依题意:(2-x)+(6-3x)+2x=7,解得:x=0.5,即c![]() (NH3)=2×0.5=1?
(NH3)=2×0.5=1?
可知c的范围是1~4之间。?
(2)原平衡时混合气体为7体积,现要减小为6.5体积,即要使反应向正(放热)方向进行,为此可在压强一定时降低反应的温度。

 阅读快车系列答案
阅读快车系列答案 (2011?泰州二模)能源、材料和信息是现代社会的三大“支柱”.
(2011?泰州二模)能源、材料和信息是现代社会的三大“支柱”.
 (2012?唐山二模)【化学--选修物质结构与性质】
(2012?唐山二模)【化学--选修物质结构与性质】
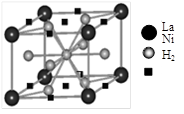
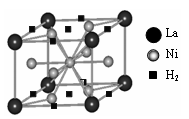
 水,由黄色变成鲜亮的红色,在空气中温度降低又变为黄色,具有可逆热色性;同时实验还表明它具有使激光倍频的二阶非线性光学性质。
水,由黄色变成鲜亮的红色,在空气中温度降低又变为黄色,具有可逆热色性;同时实验还表明它具有使激光倍频的二阶非线性光学性质。