题目内容
在4 L密闭容器中充入6 mol A气体和5 mol B气体,在一定条件下发生反应:3A(g)+B(g) 2C(g)+xD(g),达到平衡时,生成了2 mol C,经测定D的浓度为0.5 mol·L-1,下列判断正确的是( )
2C(g)+xD(g),达到平衡时,生成了2 mol C,经测定D的浓度为0.5 mol·L-1,下列判断正确的是( )
 2C(g)+xD(g),达到平衡时,生成了2 mol C,经测定D的浓度为0.5 mol·L-1,下列判断正确的是( )
2C(g)+xD(g),达到平衡时,生成了2 mol C,经测定D的浓度为0.5 mol·L-1,下列判断正确的是( )| A.x=1 |
| B.B的转化率为20% |
| C.平衡时A的浓度为1.50 mol·L-1 |
| D.达到平衡时,在相同温度下容器内混合气体的压强是反应前的85% |
B
n(D)="0.5" mol·L-1×4 L="2" mol,则生成C和D的物质的量相等,所以x=2。根据三行式解法求得A的平衡浓度和B的转化率:
3A(g) + B(g) 2C(g) + 2D(g)
2C(g) + 2D(g)
起始 6 mol 5 mol 0 0
转化 3 mol 1 mol 2 mol 2 mol
平衡 3 mol 4 mol 2 mol 2 mol
所以α(B)=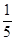 ×100%=20%,c平(A)=
×100%=20%,c平(A)=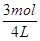 ="0.75" mol·L-1,又因为x=2,该反应是气体分子总数不变的等体反应,故达到平衡状态时的压强与反应前相同。只有B项正确。
="0.75" mol·L-1,又因为x=2,该反应是气体分子总数不变的等体反应,故达到平衡状态时的压强与反应前相同。只有B项正确。
3A(g) + B(g)
 2C(g) + 2D(g)
2C(g) + 2D(g)起始 6 mol 5 mol 0 0
转化 3 mol 1 mol 2 mol 2 mol
平衡 3 mol 4 mol 2 mol 2 mol
所以α(B)=
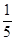 ×100%=20%,c平(A)=
×100%=20%,c平(A)=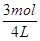 ="0.75" mol·L-1,又因为x=2,该反应是气体分子总数不变的等体反应,故达到平衡状态时的压强与反应前相同。只有B项正确。
="0.75" mol·L-1,又因为x=2,该反应是气体分子总数不变的等体反应,故达到平衡状态时的压强与反应前相同。只有B项正确。
练习册系列答案
相关题目
 CO2+NO的反应,达到化学平衡后,降低温度,混合物的颜色变浅。下列关于该反应的说法正确的是( )
CO2+NO的反应,达到化学平衡后,降低温度,混合物的颜色变浅。下列关于该反应的说法正确的是( ) 2SO3体系中,加入一定量的18O2,足够长时间后,在_______________物质中存在18O原子。
2SO3体系中,加入一定量的18O2,足够长时间后,在_______________物质中存在18O原子。 2Z(g)。现将X和Y按体积比1∶2混合于一密闭容器中,并加压到3×107 Pa时达到平衡状态。此时反应物、生成物的物质的量之比为6∶1,则此时对应于图28中的温度应为( )
2Z(g)。现将X和Y按体积比1∶2混合于一密闭容器中,并加压到3×107 Pa时达到平衡状态。此时反应物、生成物的物质的量之比为6∶1,则此时对应于图28中的温度应为( )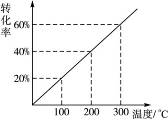
 2SO3(g)。现取3 L SO2和6 L O2混合,当反应达到平衡后,测得混合气体的体积减小10%。
2SO3(g)。现取3 L SO2和6 L O2混合,当反应达到平衡后,测得混合气体的体积减小10%。 C(g)+D(g)已达到平衡状态的是( )
C(g)+D(g)已达到平衡状态的是( ) xC(g)+4D(g),若按下列两种配比在同温同体积的密闭容器中进行反应:
xC(g)+4D(g),若按下列两种配比在同温同体积的密闭容器中进行反应: 2Z(g);△H<0,下图表示该反应的速率(v)随时间(t)变化的关系,t1、t3、t4时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中不正确的是
2Z(g);△H<0,下图表示该反应的速率(v)随时间(t)变化的关系,t1、t3、t4时刻外界条件有所改变,但都没有改变各物质的初始加入量。下列说法中不正确的是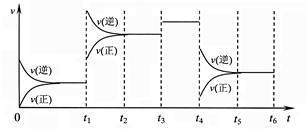
 B+3C处于平衡状态的是( )
B+3C处于平衡状态的是( )