题目内容
【题目】硫单质及其化合物在化工生产等领域应用广泛。
(1)工业尾气中的SO2一直是环境污染的主要原因之一,工业上常采用如下方法降低尾气中的含硫量。
①方法1:燃煤中加入生石灰,将SO2转化为CaSO3,再氧化为CaSO4。
已知:a.CaO(s)+CO2(g)=CaCO3(s) ΔH= -178.3 kJ·mol-1;
b.2CaCO3(s)+2SO2(g)+O2(g)=2CaSO4(s)+2CO2(g) ΔH= -2762.2 kJ·mol-1 ;
c.2CaSO3(s)+O2(g)=2CaSO4(s) ΔH= -2314.8 kJ·mol-1 。
写出CaO(s)与SO2(g)反应生成CaSO3(s)的热化学方程式:______。
②方法2:用氨水将SO2转化为NH4HSO3,再氧化为(NH4)2SO4。实验测得NH4HSO3溶液中![]() =1500,则溶液的pH为_______。(已知:H2SO3的Ka1=1.5×10-2,Ka2=1.0×10-7)
=1500,则溶液的pH为_______。(已知:H2SO3的Ka1=1.5×10-2,Ka2=1.0×10-7)
(2)煤制得的化工原料气中含有羰基硫(O=C=S),该物质可转化为H2S,反应为COS(g)+H2(g)H2S(g)+CO(g) ΔH>0。
①恒温、恒容条件下,密闭容器中发生上述反应,下列事实不能说明反应达到平衡状态的是__(填字母)。
a.COS的浓度保持不变 b.化学平衡常数不再改变
c.混合气体的密度不再改变 d.形成2mol H-S键的同时形成1 mol H-H键
②T1℃时,在恒容的密闭容器中,将定量的CO和H2S混合加热并达到平衡:H2S(g)+CO(g)COS(g)+H2(g) K=0.25。则该温度下反应COS(g)+H2(g) H2S(g)+CO(g)的平衡常数K'=__。
③T1℃时,向容积为10 L的恒容密闭容器中充入1mol COS(g)和1mol H2(g),达到平衡时COS的转化率为____。(计算结果保留到小数点后一位)
(3)过二硫酸(H2S2O8)是一种强氧化性酸,其结构式为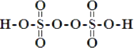 。在Ag+催化作用下,S2O82-能与Mn2+在水溶液中发生反应生成SO42-和MnO4-,1 mol S2O82-能氧化的Mn2+的物质的量为__mol。
。在Ag+催化作用下,S2O82-能与Mn2+在水溶液中发生反应生成SO42-和MnO4-,1 mol S2O82-能氧化的Mn2+的物质的量为__mol。
【答案】CaO(s)+SO2(g)=CaSO3(s) ΔH=-402.0 kJ·mol-1 6 bc 4 66.7% 0.4
【解析】
(1)①已知: a.CaO(s)+CO2(g)=CaCO3(s) ΔH= -178.3 kJ·mol-1;
b.2CaCO3(s)+2SO2(g)+O2(g)=2CaSO4(s)+2CO2(g) ΔH= -2762.2 kJ·mol-1 ;
c.2CaSO3(s)+O2(g)=2CaSO4(s) ΔH= -2314.8 kJ·mol-1 。
利用盖斯定律,将a+b×![]() -c×
-c×![]() ,即得CaO(s)与SO2(g)反应生成CaSO3(s)的热化学方程式CaO(s)+SO2(g)=CaSO3(s) ΔH=-402.0 kJ·mol-1。答案为:CaO(s)+SO2(g)=CaSO3(s) ΔH=-402.0 kJ·mol-1;
,即得CaO(s)与SO2(g)反应生成CaSO3(s)的热化学方程式CaO(s)+SO2(g)=CaSO3(s) ΔH=-402.0 kJ·mol-1。答案为:CaO(s)+SO2(g)=CaSO3(s) ΔH=-402.0 kJ·mol-1;
②根据亚硫酸的两步电离方程式可知Ka1=![]() 、Ka2=
、Ka2=![]() ,Ka1Ka2 =
,Ka1Ka2 =![]() ,即c2(H+)×1500=1.5×10-2×1.0×10-7,c(H+)=1.0×10-6mol/L,pH=6。答案为:6;
,即c2(H+)×1500=1.5×10-2×1.0×10-7,c(H+)=1.0×10-6mol/L,pH=6。答案为:6;
(2)①a.COS的浓度保持不变,表明正逆反应速率相等,反应达平衡状态,a不合题意;
b.化学平衡常数不再改变,表明温度不变,反应不一定达平衡状态,b符合题意;
c.混合气体的质量和体积不变,密度始终不变,反应不一定达平衡状态,c符合题意;
d.形成2mol H-S键的同时形成1 mol H-H键,表明正逆反应速率相等,反应达平衡状态,d不合题意;
故选bc。答案为:bc;
②该温度下反应COS(g)+H2(g)![]() H2S(g)+CO(g)的平衡常数K'=
H2S(g)+CO(g)的平衡常数K'=![]() =
=![]() =4。答案为:4;
=4。答案为:4;
③设参加反应的COS的物质的量为x,建立三段式:
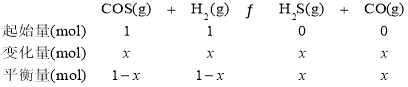
K'=![]() =
=![]() =4,从而求出x=
=4,从而求出x=![]() ,则达到平衡时COS的转化率为
,则达到平衡时COS的转化率为 =66.7%。答案为:66.7%;
=66.7%。答案为:66.7%;
(3)利用得失电子守恒,建立关系式:5S2O82-——2Mn2+,则1 mol S2O82-能氧化的Mn2+的物质的量为![]() ×1mol=0.4mol。答案为:0.4。
×1mol=0.4mol。答案为:0.4。

【题目】下列实验操作不能达到实验目的的是
选项 | 实验目的 | 实验操作 |
A | 比较金属镁和铝的活泼性 | 分別向两只盛有等体积等浓度的稀硫酸烧杯中加入打磨过的同样大小的镁片和铝片,比较反应现象 |
B | 除去Mg粉中混有的Al 粉 | 加入足量的NaOH 溶液,过滤、洗涤、干燥 |
C | 探究维生素C的还原性 | 向盛有2 mL黄色氯化铁溶液的试管中滴加浓的维生素C溶液,观察颜色变化 |
D | 配制0.4000mol·L1的NaOH溶液 | 称取4.0g固体NaOH于烧杯中,直接向烧杯中加入250mL水 |
A. AB. BC. CD. D
【题目】由下列实验现象一定能得出相应结论的是
选项 | A | B | C | D |
装置图 |
|
|
|
|
现象 | 右边试管产生气泡较快 | 左边棉球变棕黄色,右边棉球变蓝色 | 试管中先出现淡黄色固体,后出现黄色固体 | 试管中液体变浑浊 |
结论 | 催化活性:Fe3+>Cu2+ | 氧化性:Br2>I2 | Ksp:AgCl>AgBr>AgI | 非金属性:C>Si |
A. AB. BC. CD. D
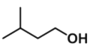
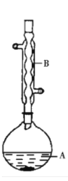
【题目】乙酸异戊酯是组成蜜蜂信息素的成分之一,具有香蕉的香味。实验室可利用乙酸与异戊醇在浓硫酸催化下加热反应制备乙酸异戊酯。实验装置示意图和有关数据如下,本实验采用环己烷作为溶剂。
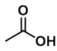 +
+
![]()
 +H2O
+H2O
物质 | 摩尔质量(g/mol) | 密度(g/mL) | 沸点(℃) | 水中的溶解性 |
异戊醇 | 88 | 0.81 | 131 | 微溶 |
乙酸 | 60 | 1.05 | 118 | 可溶 |
乙酸异戊酯 | 130 | 0.80 | 142 | 难溶 |
环己烷 | 84 | 0.78 | 81 | 难溶 |
实验步骤:
①在A中加入 4.4 g 的异戊醇、6.0 g 的冰醋酸、1.0 mL 浓硫酸、25 mL 环己烷和搅拌磁子。在仪器A上方放置仪器B,保证磨口严密,并将整个装置固定。
②打开磁力搅拌并缓慢加热A,直到溶剂开始回流。保持此温度加热,维持体系回流 50 分钟。
③反应液冷至室温后倒入分液漏斗中,用25mL水洗一次,再用5%碳酸氢钠溶液洗至中性。
④最后再用水洗涤有机层一次,分出的产物加入少量无水硫酸镁固体,静置片刻。
⑤过滤除去硫酸镁固体,进行蒸馏纯化,收集合适馏分,得乙酸异戊酯 3.51 g。
(1)仪器B 的名称为_____________。
(2)步骤②中,在“打开磁力搅拌并缓慢加热A”前,遗漏了一个重要操作。此疏漏可造成整个实验失败并引起火灾风险。此遗漏的操作为 _______________________。
(4)步骤⑤中通过蒸馏获得最终产品时,实验者应在_________℃ 左右收集产品。通过计算,本实验的产率是_____________。
(5)在真实的合成实验中,往往会在装置 A 与装置 B 之间添加一个分水器(如图)。其基本工作原理是:溶剂环己烷和反应中生成的水形成二元共沸物,沸腾时二者共同蒸出,经冷凝后落入分水器中。此时分水器中液体也会分层,被带出的水分处于_________层(选填上或下)。由上述工作原理可知,分水器在此实验中最大的作用是________。分水器的另一重要用途是观察和控制反应进度。假设本实验产率达到 100%,且反应生成的水被全部蒸出并完全冷凝,则分水器中可分离得到的水的体积为_____mL。(水的密度取1.00 g/mL,不考虑浓硫酸中的水分)