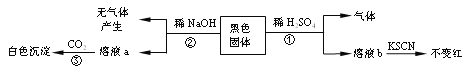
题目内容
【题目】丙烷燃烧可以通过以下两种途径:
途径Ⅰ:C3H8(g)+5O2(g)=3CO2(g)+4H2O(l) ΔH=-a kJ/mol
途径Ⅱ:C3H8(g)=C3H6(g)+H2(g) ΔH=+b kJ/mol
2C3H6(g)+9O2(g)=6CO2(g)+6H2O(l) ΔH=-c kJ/mol
2H2(g)+O2(g)=2H2O(l) ΔH=-d kJ/mol (a、b、c、d 均为正值)
请回答下列问题:
(1)判断等量的丙烷通过两种途径放出的热量,途径Ⅰ放出的热量 ________(填“大于 ”、“等于 ” 或“小于 ”)途径Ⅱ放出的热量。
(2)由于C3H8(g)=C3H6(g)+H2(g)的反应中,反应物具有的总能量_____(填“大于”、“等 于”或“小于 ”)生成物具有的总能量,那么在化学反应时,反应物就需要_____(填“放出 ” 或“吸收 ”)能量才能转化为生成物,因此其反应条件是____;
(3)b与a、c、d 的数学关系式是_____________________________________。
【答案】等于 小于 吸收 加热 ![]()
【解析】
(1)根据盖斯定律来判断两种途径放热之间的关系;
(2)该反应属于吸热反应,反应物具有的总能量小于生成物的总能量;
(3)途径I:①C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H=-a kJmol-1
途径II:②C3H8(g)═C3H6(g)+H2(g)△H=+b kJmol-1
③2C3H6(g)+9O2(g)═6CO2(g)+6H2O(l)△H=-c kJmol-1
④2H2(g)+O2(g)═2H2O(l)△H=-d kJmol-1反应①=反应②+反应③×![]() +反应④×
+反应④×![]() ,据盖斯定律来判断各步反应之间的关系。
,据盖斯定律来判断各步反应之间的关系。
(1)根据盖斯定律,煤作为燃料不管是一步完成还是分两步完成,反应物和产物的焓值是一定的,所以两途径的焓变值一样,放出的热量一样;
(2)由于C3H8(g)═C3H6(g)+H2(g)的反应中△H>0,该反应是吸热反应,反应物具有的总能量小于生成物的总能量;
(3)途径I:①C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H=akJmol1
途径II:②C3H8(g)═C3H6(g)+H2(g)△H=+bkJmol1
③2C3H6(g)+9O2(g)═6CO2(g)+6H2O(l)△H=ckJmol1
④2H2(g)+O2(g)═2H2O(l)△H=dkJmol1反应①=反应②+反应③×![]() +反应④×
+反应④×![]() ,据盖斯定律来判断各步反应之间的关系所以a=b+
,据盖斯定律来判断各步反应之间的关系所以a=b+![]() ×(cd),所以b=a+
×(cd),所以b=a+![]() ×(c+d),2b=c+d2a,即b=
×(c+d),2b=c+d2a,即b=![]() +
+![]() a=
a=![]() 。
。