题目内容
【题目】甲醇是一种可再生的绿色能源,![]() 是一种温室气体,都是重要的化工原料。
是一种温室气体,都是重要的化工原料。
(1)已知CO的燃烧热![]() 为
为![]() ,CO(g)+2H2(g)
,CO(g)+2H2(g)![]() CH3OH(1);△H=-129kJmol-1,欲求出
CH3OH(1);△H=-129kJmol-1,欲求出![]() 的燃烧热,则需要知道一个反应,该反应的热化学方程式为____________________.(无需写出
的燃烧热,则需要知道一个反应,该反应的热化学方程式为____________________.(无需写出![]() 的具体数值)
的具体数值)
(2)向温度不同容积均为1L的a、b、c、d、e五个恒容密闭容器中各充入![]() 、
、![]() 的混合气体,控制适当条件使其同时发生反应:CO2(g)+3H2(g)
的混合气体,控制适当条件使其同时发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)△H=QkJmol-1,反应过程中维持各容器温度不变,测得
CH3OH(g)+H2O(g)△H=QkJmol-1,反应过程中维持各容器温度不变,测得![]() 时刻各容器中
时刻各容器中![]() 的体积分数(H2O)如图所示。
的体积分数(H2O)如图所示。

①Q_______(填“>”或“<”)0,五个容器中肯定处于非平衡状态的是_________。
②![]() 时刻时,容器a中正反应速率________(填“大于”“小于”或“等于”)容器e中正反应速率;
时刻时,容器a中正反应速率________(填“大于”“小于”或“等于”)容器e中正反应速率;
③![]() ℃时,该反应的平衡常数K=__________;
℃时,该反应的平衡常数K=__________;
④欲提高![]() 的转化率,可采取的措施有______________________(写出两种);
的转化率,可采取的措施有______________________(写出两种);
(3)碳捕捉技术的应用既可降低碳排放也可得到重要的化工产品.
①![]() 溶液是常用的碳捕捉剂,若某次捕捉后得到的溶液中c(HCO3-)∶c(CO32-)=2∶1,则所得溶液的pH=__________[常温下
溶液是常用的碳捕捉剂,若某次捕捉后得到的溶液中c(HCO3-)∶c(CO32-)=2∶1,则所得溶液的pH=__________[常温下![]() 、
、![]() ]。
]。
②在清除锅炉水垢的过程中,需要用![]() 将水垢中的
将水垢中的![]() 转化为
转化为![]() ,将微溶的
,将微溶的![]() 难溶性的
难溶性的![]() 的理由是_____________________________________________.
的理由是_____________________________________________.
【答案】![]()
![]() < a、b 小于 4 降低温度或者增大二氧化碳的量或者增大压强 10
< a、b 小于 4 降低温度或者增大二氧化碳的量或者增大压强 10 ![]() 难溶于酸,而
难溶于酸,而![]() 易溶于酸中
易溶于酸中
【解析】
(1)根据CH3OH燃烧生成二氧化碳和液态水,所以根据盖斯定律还应该有生成二氧化碳和液态水的热化学方程式,因为CO的燃烧热△H为-283kJmol-1,则有生成二氧化碳,还要有生成液态水,则必须涉及氢气燃烧的反应,据此分析;
(2)①a、b、c、d、e五个恒容密闭容器,由图像可知对应温度依次升高,则反应速率也依次增大,由于c中水的体积分数最大,表明t1时刻d、e已处于平衡状态,a、b肯定没有达到平衡状态,c可能处于平衡状态;因为达到平衡后,升高温度水的体积分数反而减小,说明升高温度平衡向逆反应进行,据此判断;②t1时刻时,a、e容器水的体积分数相等,说明a、e容器中反应物浓度相同,则温度越高正反应速率越大;③根据K=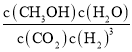 结合三段式计算;④根据欲提高H2的转化率,即在不改变氢气的量时使平衡正向移动即可;
结合三段式计算;④根据欲提高H2的转化率,即在不改变氢气的量时使平衡正向移动即可;
(3)①某次捕捉后得到的溶液中c(HCO3-)∶c(CO32-)=2∶1,则溶液酸碱性主要由CO32-+H2O![]() HCO3-+OH-,K=
HCO3-+OH-,K=![]() =
=![]() ,据此计算出氢氧根离子浓度,从而求出pH;②根据CaSO4难溶于酸难除去,而CaCO3易溶于酸中易除去分析。
,据此计算出氢氧根离子浓度,从而求出pH;②根据CaSO4难溶于酸难除去,而CaCO3易溶于酸中易除去分析。
(1)欲求出CH3OH的燃烧热,根据CH3OH燃烧生成二氧化碳和液态水,所以根据盖斯定律还应该有生成二氧化碳和液态水的热化学方程式,又已知CO的燃烧热△H为-283kJmol-1,即CO (g)+![]() O2 (g)
O2 (g)![]() CO2(g)△H=-283kJmol-1;那还必须有生成液态水的热化学方程式,则需要知道一个H2 (g)燃烧的热化学方程式,所以该反应的热化学方程式为2H2 (g)+O2 (g)
CO2(g)△H=-283kJmol-1;那还必须有生成液态水的热化学方程式,则需要知道一个H2 (g)燃烧的热化学方程式,所以该反应的热化学方程式为2H2 (g)+O2 (g)![]() 2H2O(l)△H,故答案为:2H2 (g)+O2 (g)
2H2O(l)△H,故答案为:2H2 (g)+O2 (g)![]() 2H2O(l)△H;
2H2O(l)△H;
(2)①a、b、c、d、e五个恒容密闭容器,由图像可知对应温度依次升高,则反应速率也依次增大,由于c中水的体积分数最大,表明t1时刻d、e已处于平衡状态,a、b肯定没有达到平衡状态,c可能处于平衡状态;又因为达到平衡后,升高温度水的体积分数反而减小,说明升高温度平衡向逆反应进行,则正反应为放热反应,即△H<0,故答案为:<;a、b;
②t1时刻时,a、e容器水的体积分数相等,说明a、e容器中反应物浓度相同,又e容器温度大于a,所以容器a中正反应速率小于容器e中正反应速率,故答案为:小于;
③ CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
开始 3mol 7mol 0 0
转化 x 3x xx
平衡 3-x 7-3x x x
根据Td℃时,平衡水的体积分数为![]() ,所以
,所以![]() =
=![]() ,解得x=2,则根据K=
,解得x=2,则根据K=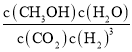 =
=![]() =4,故答案为:4;
=4,故答案为:4;
④根据CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)为体积减小的放热反应,所以欲提高H2的转化率,可以降低温度或者增大二氧化碳的量或者增大压强,故答案为:降低温度或者增大二氧化碳的量或者增大压强;
CH3OH(g)+H2O(g)为体积减小的放热反应,所以欲提高H2的转化率,可以降低温度或者增大二氧化碳的量或者增大压强,故答案为:降低温度或者增大二氧化碳的量或者增大压强;
(3)①某次捕捉后得到的溶液中c(HCO3-)∶c(CO32-)=2∶1,则溶液酸碱性主要由CO32-+H2OHCO3-+OH-,K=![]() =
=![]() ,所以c(OH-)=
,所以c(OH-)=![]() =
=![]() =10-4,则c(H+)=10-10,pH=-lgc(H+)=10,故答案为:10;
=10-4,则c(H+)=10-10,pH=-lgc(H+)=10,故答案为:10;
②因为CaSO4难溶于酸难除去,而CaCO3易溶于酸中易除去,所以在清除锅炉水垢的过程中,需要用Na2CO3将水垢中的CaSO4转化为CaCO3,故答案为:CaSO4难溶于酸,而CaCO3易溶于酸中。

【题目】(一)碳酸镧![]() 可用于治疗终末期肾病患者的高磷酸盐血症,制备反应原理为:2LaCl3+6NH4HCO3═La2(CO3)3↓+6NH4Cl+3CO2↑+3H2O;某化学兴趣小组利用下列装置实验室中模拟制备碳酸镧。
可用于治疗终末期肾病患者的高磷酸盐血症,制备反应原理为:2LaCl3+6NH4HCO3═La2(CO3)3↓+6NH4Cl+3CO2↑+3H2O;某化学兴趣小组利用下列装置实验室中模拟制备碳酸镧。

(1)制备碳酸镧实验流程中导管从左向右的连接顺序为:F→_____→_____→_____→_____→_____;
(2)Y中发生反应的化学反应式为_______________;
(3)X中盛放的试剂是___________,其作用为___________________;
(4)Z中应先通入![]() ,后通入过量的
,后通入过量的![]() ,原因为__________________;
,原因为__________________;
二、氢氧化铈![]() 是一种重要的稀土氢氧化物,它可由氟碳酸铈精矿(主要含
是一种重要的稀土氢氧化物,它可由氟碳酸铈精矿(主要含![]() )经如下流程获得:
)经如下流程获得:

已知:在酸性溶液中![]() 有强氧化性,回答下列问题:
有强氧化性,回答下列问题:
(5)氧化焙烧生成的铈化合物二氧化铈(![]() ),其在酸浸时反应的离子方程式为_________________;
),其在酸浸时反应的离子方程式为_________________;
(6)已知有机物HT能将![]() 从水溶液中萃取出来,该过程可表示为:
从水溶液中萃取出来,该过程可表示为:![]() (水层)+
(水层)+![]() (有机层)
(有机层)![]()
![]() +
+![]() (水层)从平衡角度解释:向
(水层)从平衡角度解释:向![]() (有机层)加入
(有机层)加入![]() 获得较纯的含
获得较纯的含![]() 的水溶液的原因是________________;
的水溶液的原因是________________;
(7)已知298K时,Ksp[Ce(OH)3]=1×10-20,为了使溶液中![]() 沉淀完全,需调节pH至少为________;
沉淀完全,需调节pH至少为________;
(8)取某![]() 产品0.50g,加硫酸溶解后,用
产品0.50g,加硫酸溶解后,用![]() 的
的![]() 溶液滴定至终点(铈被还原成
溶液滴定至终点(铈被还原成![]() ).(已知:
).(已知:![]() 的相对分子质量为208)
的相对分子质量为208)
①![]() 溶液盛放在________(填“酸式”或“碱式”)滴定管中;
溶液盛放在________(填“酸式”或“碱式”)滴定管中;
②根据下表实验数据计算![]() 产品的纯度____________;
产品的纯度____________;
滴定次数 |
| |
滴定前读数 | 滴定后读数 | |
第一次 | 0.50 | 23.60 |
第二次 | 1.00 | 26.30 |
第三次 | 1.20 | 24.10 |
③若用硫酸酸化后改用![]() 的
的![]() 溶液滴定产品从而测定
溶液滴定产品从而测定![]() 产品的纯度,其它操作都正确,则测定的
产品的纯度,其它操作都正确,则测定的![]() 产品的纯度____________(填“偏高”、“偏低”或“无影响”)。
产品的纯度____________(填“偏高”、“偏低”或“无影响”)。