题目内容
(9分)在一定温度下, 把2molN2和6molH2通入体积不变的容器中。容器中发生以下反应: N2(g) + 3H2(g)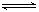 2NH3(g) ,△H= —QKJ/mol。若反应达平衡后, 测得混合气体为7mol。据此回答下列问题:
2NH3(g) ,△H= —QKJ/mol。若反应达平衡后, 测得混合气体为7mol。据此回答下列问题:
保持上述反应温度不变, 设a.b.c分别代表起始加入的N2.H2和NH3的物质的量。如果反应达平衡后混合气体中各物质的百分含量仍与上述平衡时完全相同, 那么:
(1)若a = 1.c =" 2," 则b = 。在此情况下, 反应起始时将向 方向进行(填“正”或“逆”)。
(2)若需规定起始时反应向逆方向进行,则c的范围是 。
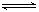 2NH3(g) ,△H= —QKJ/mol。若反应达平衡后, 测得混合气体为7mol。据此回答下列问题:
2NH3(g) ,△H= —QKJ/mol。若反应达平衡后, 测得混合气体为7mol。据此回答下列问题:保持上述反应温度不变, 设a.b.c分别代表起始加入的N2.H2和NH3的物质的量。如果反应达平衡后混合气体中各物质的百分含量仍与上述平衡时完全相同, 那么:
(1)若a = 1.c =" 2," 则b = 。在此情况下, 反应起始时将向 方向进行(填“正”或“逆”)。
(2)若需规定起始时反应向逆方向进行,则c的范围是 。
(1)3 , 逆 ,
(2)1<c≤4
(2)1<c≤4
试题分析: N2(g) + 3H2(g)
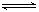 2NH3(g)
2NH3(g)起始(mol) 2 6
转化(mol) x 3x 2x
平衡(mol)2-x 6-3x 2x
8-2x=7,x=0.5mol。
(1) N2(g) + 3H2(g)
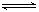 2NH3(g)
2NH3(g)平衡(mol) 1.5 4.5 1
某时刻(mol)1 b 2
根据以上数据知b=3,因为反应物的量小于平衡量,说明反应向逆反应进行。
(2)向逆向移动,则氨气的量必须大于平衡量1mol,同时不能高于最大值4mol,范围是1<c≤4。
点评:利用三行式可以快速解决化学平衡计算。

练习册系列答案
 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案
相关题目
 2HI(g);△H<0,并达平衡。HI的体积分数w(HI)随时间变化如图曲线(Ⅱ)所示
2HI(g);△H<0,并达平衡。HI的体积分数w(HI)随时间变化如图曲线(Ⅱ)所示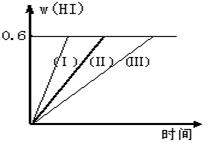
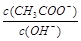 变大
变大
 ?CH3OH(g)。
?CH3OH(g)。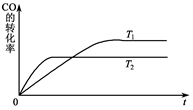
 2NH3(g) ;△H=" —92.4" KJ·mol—1。现在500℃、20 MPa时,将N2、H2置于一个容积为2 L的密闭容器中发生反应,反应过程中各物质的物质的量变化如下图。回答下列问题:
2NH3(g) ;△H=" —92.4" KJ·mol—1。现在500℃、20 MPa时,将N2、H2置于一个容积为2 L的密闭容器中发生反应,反应过程中各物质的物质的量变化如下图。回答下列问题: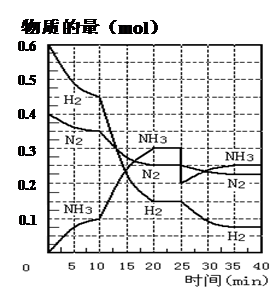
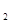 (g)+1/2O
(g)+1/2O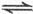 SO
SO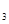 (g)△H=-98.32kJ/mol,现有4molSO
(g)△H=-98.32kJ/mol,现有4molSO