题目内容
(7分)向10mL 0.5mol·L-1的Na2CO3溶液中加入一定体积1mol·L-1的盐酸,恰好完全反应。试计算:
(1)加入盐酸的体积;
(2)反应生成气体的体积(标准状况);
(3)假设反应前后溶液体积不变,求所得溶液中的Na+的物质的量浓度。
解:
n(Na2CO3) =0.01L×0.5 mol·L-1=0.005mol
设加入盐酸的物质的量为x mol,生成气体的物质的量为y mol
Na2CO3 + 2HCl = 2NaCl + CO2↑ + H2O…………………………(1分)
1 mol 2mol 1 mol
0.005mol xmol y mol
(1) x=0.01
V(HCl)=n(HCl)÷c(HCl)=0.01 mol ÷ 1 mol·L-1=0.01 L……………………(2分)
(2)y=0.005
V(CO2)= n(CO2)×Vm=0.005 mol × 22.4 L·mol-1=0.112 L……………………(2分)
(3)根据反应前后Na元素物质的量守恒
n(Na+)= 2 n(Na2CO3)
c(Na+)= 2×0.005mol÷(0.01L+0.01L)=0.5 mol·L-1……………………(2分)
答:略
解析:略

练习册系列答案
相关题目
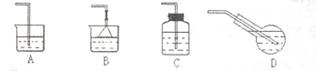
下列有关实验操作及实验结论正确的是( )
| A、金属钠着火,可用泡沫灭火器扑灭 | B、用10mL量筒准确量取7.50mL稀硫酸 | C、用四氯化碳萃取溴水中的溴时,将溴的四氯化碳溶液从分液漏斗下口放出 | D、向淀粉溶液中加入稀硫酸,加热几分钟后冷却,再加入新制的Cu(OH)2悬浊液,加热,没有砖红色沉淀生成,证明淀粉没有水解成葡萄糖 |
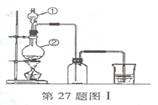 (1)填写仪器名称:图中①是
(1)填写仪器名称:图中①是