题目内容
(7分)图I是实验室制取氯气的装拦图,根据要求填空回答。
![]()
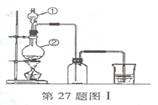 (1)填写仪器名称:图中①是
(1)填写仪器名称:图中①是
![]() (2)烧瓶中发生反应的化学方程式是
(2)烧瓶中发生反应的化学方程式是
![]() (3)如图Ⅱ所示,
(3)如图Ⅱ所示,
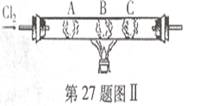
在硬质玻璃管中的A、B、C三处放有喷上少量KBr溶液、KI溶液、淀粉溶液的三个棉球。向左端导人 Cl2,在B处加热,可观察到A处棉球呈 色,B处棉球呈 色,C处棉球呈 色。
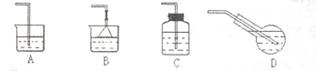
![]() (4)若制备饱和氯水,应选用的最佳吸收装置是
(4)若制备饱和氯水,应选用的最佳吸收装置是
![]()
![]()
![]()
![]()
![]()
(5)若实验中使用12mol/L的浓盐酸10ml与足量的MnO2反应,则生成Cl2的物质的量是
![]() A.大于O.03mol B.小于O.03mol C.等于0.93mol
A.大于O.03mol B.小于O.03mol C.等于0.93mol
(1)分液漏斗(1分)
(2)Mn02+4HCl=MnCl4+C12↑+2H20(1分)
(3)橙色(1分)黄色(1分)蓝色(1分)
(4)D(1分)
(5)B(1分)

 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案某化学小组以苯甲酸为原料,制取苯甲酸甲酯。已知有关物质的沸点如下表:
|
物质 |
甲醇 |
苯甲酸 |
苯甲酸甲酯 |
|
沸点/℃ |
64.7 |
249 |
199.6 |
I. 合成苯甲酸甲酯粗产品
在圆底烧瓶中加入12.2g 苯甲酸和20 mL 甲醇(密度约0.79g ? mL-1) ,再小心加入3 mL 浓硫酸,混匀后,投入几粒碎瓷片,小心加热使反应完全,得苯甲酸甲酯粗产品。
(1)浓硫酸的作用是_________________________________;若反应产物水分子中有同位素18O,写出能表示反应前后18O位置的化学方程式:_________________________________________________。
(2)甲、乙、丙三位同学分别设计了如图三套实验室制取苯甲酸甲酯的装置(夹持仪器和加热仪器均已略去)。根据有机物的沸点,最好采用 装置(填:甲、乙、丙)。

II. 粗产品的精制
(3)苯甲酸甲酯粗产品中往往含有少量甲醇、硫酸、苯甲酸和水等,现拟用下列流程图进行精制,请根据流程图填入恰当操作方法的名称:操作I为 ,操作II为 。
(4)以上流程图中加入Na2CO3溶液后,放入分液漏斗中振荡、静置,要得到有机层,其具体操作是
_____________________________________________________。
(5)通过计算,苯甲酸甲酯的产率为_________________________。
(10分)
I.(4分)某温度下的溶液中,c(H+)=10x mol/L,c(OH-)=10y mol/L。x与y的关系如图所示:

(1)该温度下,中性溶液的pH= 。
(2)该温度下0.01 mol/L NaOH溶液的pH= 。
II. (6分)某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定。
(1)将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s) 2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列于下表:
2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列于下表:
|
温度(℃) |
15.0 |
20.0 |
25.0 |
30.0 |
35.0 |
|
平衡总压强(kPa) |
5.7 |
8.3 |
12.0 |
17.1 |
24.0 |
|
平衡气体总浓度 (×10-3mol/L) |
2.4 |
3.4 |
4.8 |
6.8 |
9.4 |
①可以判断该分解反应已经达到化学平衡的是 (填字母)。
A.2v(NH3)=v(CO2) B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变 D.密闭容器中氨气的体积分数不变
②根据表中数据,计算25.0℃时的分解平衡常数为 。
(2)已知:NH2COONH4+2H2O NH4HCO3+NH3·H2O。该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间变化趋势如图所示。
NH4HCO3+NH3·H2O。该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间变化趋势如图所示。

③计算25℃时,0~6min氨基甲酸铵水解反应的平均速率为 。
④根据图中信息,如何说明水解反应的平均速率随温度升高而增大:
。
 I.(4分)某温度下的溶液中,c(H+)=10x mol/L,c(OH-)=10y mol/L。x与y的关系如图所示:
I.(4分)某温度下的溶液中,c(H+)=10x mol/L,c(OH-)=10y mol/L。x与y的关系如图所示:
(1)该温度下,中性溶液的pH= 。
(2)该温度下0.01 mol/L NaOH溶液的pH= 。
II. (6分)某研究小组在实验室探究氨基甲酸铵(NH2COONH4)分解反应平衡常数和水解反应速率的测定。
(1)将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)![]() 2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列于下表:
2NH3(g)+CO2(g)。实验测得不同温度下的平衡数据列于下表:
| 温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
| 平衡总压强(kPa) | 5.7 | 8.3 | 12.0 | 17.1 | 24.0 |
| 平衡气体总浓度 (×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
①可以判断该分解反应已经达到化学平衡的是 (填字母)。
A.2v(NH3)=v(CO2) B.密闭容器中总压强不变
C.密闭容器中混合气体的密度不变 D.密闭容器中氨气的体积分数不变
②根据表中数据,计算25.0℃时的分解平衡常数为 。
(2)已知:NH2COONH4+2H2O![]() NH4HCO3+NH3·H2O。该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间变化趋势如图所示。
NH4HCO3+NH3·H2O。该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间变化趋势如图所示。
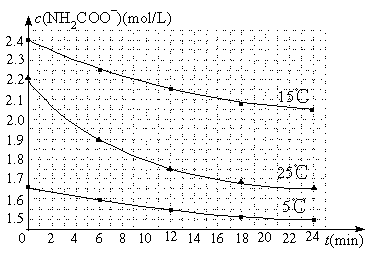
③计算25℃时,0~6min氨基甲酸铵水解反应的平均速率为 。
④根据图中信息,如何说明水解反应的平均速率随温度升高而增大:
。
