题目内容
【题目】氧化还原反应在生产、生活中具有广泛的用途、贯穿古今.
(1)水是人体的重要组成部分,是人体中含量最多的一种物质.而“四种基本反应类型与氧化还原反应的关系”也可用图表达.试写出有水参加的符合反应类型Ⅳ的一个化学方程式: , 其中水为剂.
(2)过氧化氢的水溶液俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口.关于双氧水,回答下列问题:
①下列反应中,H2O2既体现氧化性又体现还原性的反应是
A.Na2O2+2HCl═2NaCl+H2O2
B.Ag2O+H2O2═2Ag+O2↑+H2O
C.2H2O2═2H2O+O2↑
D.3H2O2+Cr2(SO4)3+10KOH═K2CrO4+3K2SO4+8H2O
②保存过氧化氢的试剂瓶上最适合贴上的一个标签是(填序号)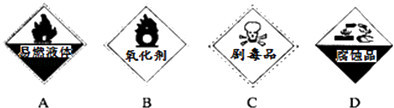
(3)焊接铜器时,可先用NH4Cl 除去其表面的氧化铜再进行焊接,该反应可表示为:
4CuO+2NH4Cl ![]() 3Cu+CuCl2+N2↑+4H2O
3Cu+CuCl2+N2↑+4H2O
①用双线桥标明电子转移的方向和数目. .
②该反应中,被氧化的元素是 , 氧化剂是 .
③还原剂与氧化产物的物质的量之比为 .
④反应中若产生0.2mol的氮气,则有mol的电子转移.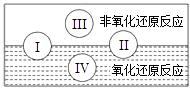
【答案】
(1)2Na+2H2O═2NaOH+H2↑;氧化
(2)C;B
(3)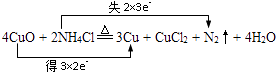 ;氮(N);CuO;2:1;1.2
;氮(N);CuO;2:1;1.2
【解析】解:(1)有水参加的符合反应类型Ⅳ的为置换反应,则既是氧化还原反应又属于置换反应的如2Na+2H2O═2NaOH+H2↑,水中H元素的化合价降低,作氧化剂,
所以答案是:2Na+2H2O═2NaOH+H2↑;氧化;(2)①A.Na2O2+2HCl═2NaCl+H2O2 , 不是氧化还原反应,故A不选; B.Ag2O+H2O2═2Ag+O2↑+H2O,过氧化氢化合价升高作还原剂,故B不选; C.2H2O2═2H2O+O2↑,过氧化氢化合价既升高又降低,既体现氧化性又体现还原性,故C选; D.3H2O2+Cr2(SO4)3+10KOH══K2CrO4+3K2SO4+8H2O,过氧化氢化合价降低,作氧化剂,故D不选;所以答案是:C;②过氧化氢具有强氧化性,所以应该贴氧化剂标签,所以答案是:B;(3)①在反应过程中,铜化合价降低,失电子,氮元素化合价升高,得电子,所以双线桥法表示为 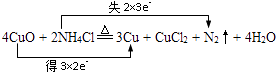 ,所以答案是:
,所以答案是: 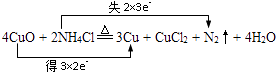 ;②氮元素化合价升高,失去电子,被氧化;氧化铜中Cu元素的化合价降低,作氧化剂,所以答案是:氮(N);CuO;③还原剂是氯化铵,氧化产物是氮气,由反应可知,二者的物质的量之比为2:1,所以答案是:2:1;④氮元素化合价由﹣3 降低为0价,生成0.2mol氮气对应失去电子为0.2×2×3=1.2mol,所以答案是:1.2.
;②氮元素化合价升高,失去电子,被氧化;氧化铜中Cu元素的化合价降低,作氧化剂,所以答案是:氮(N);CuO;③还原剂是氯化铵,氧化产物是氮气,由反应可知,二者的物质的量之比为2:1,所以答案是:2:1;④氮元素化合价由﹣3 降低为0价,生成0.2mol氮气对应失去电子为0.2×2×3=1.2mol,所以答案是:1.2.

 星级口算天天练系列答案
星级口算天天练系列答案