题目内容
管道工人曾经用浓氨水检查氯气管道是否漏气。已知能发生如下反应:(在有水蒸气存在的条件下) 2NH3+3Cl2=6HCl+N2 下列说法中错误的是( )
| A.用该方法检验管道泄漏处会产生白烟 |
| B.管道泄漏处会闻到刺激性气味 |
| C.该反应生成1mol氮气时,转移3mol电子 |
| D.可以用浸有稀碱液的布包裹在管道泄漏处,暂时防止氯气的危害 |
C
解析试题分析:A、若管道漏气,发生反应3Cl2+2NH3=N2+6HCl,反应生成的HCl与NH3反应生成NH4Cl,有白烟生成,正确;B、氯气具有刺激性气味,所以管道泄漏处会闻到刺激性气味,正确;C、该反应中氮元素的化合价由反应前的-3价变为反应后的0价,所以生成1mol氮气转移6mol电子,错误;D、氯气能与碱溶液反应,所以可以用浸有稀碱液的布包裹在管道泄漏处,暂时防止氯气的危害,正确。
考点:考查氯气的化学性质和氧化还原反应有关知识。

 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案下列自然、生活中的事例不属于氧化还原反应的是
| A.动物呼吸 | B.植物光合作用 | C.金属生锈 | D.石膏点制豆腐 |
根据下列各反应,判断有关物质还原性由强到弱的顺序是( )
① H2SO3+I2+H2O = 2HI + H2SO4
② 2FeCl3+2HI=2FeCl2 + 2HCl + I2
③ 3FeCl2 + 4HNO3=2FeCl3 + NO↑ + 2H2O +Fe(NO3)3
| A.FeCl2>HI>H2SO3>NO | B.H2SO3>HI>FeCl2>NO |
| C.I2>FeCl2>H2SO3>NO | D.NO>FeCl2>H2SO3>HI |
新型净水剂高铁酸钾(K2FeO4)为暗紫色固体,可溶于水。工业上常通过以下两步反应制备K2FeO4:①2FeCl3+10NaOH+3NaClO=2Na2FeO4+9NaCl+5H2O ②Na2FeO4 + 2KOH=K2FeO4 + 2NaOH
下列说法不正确的是
| A.反应①为氧化还原反应,反应②为复分解反应 |
| B.反应①中Na2FeO4是还原产物 |
| C.Na2FeO4 中Fe为+6价,具有强氧化性,能杀菌消毒 |
| D.若有2 mol FeCl3发生反应,转移电子的物质的量为 6 mol |
汽车剧烈碰撞时,安全气囊中发生反应: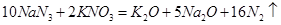 。则下列判断错误的是.
。则下列判断错误的是.
| A.该反应能在瞬间完成,并产生大量气体 |
| B.生成标准状况下2.24L气体,该反应转移电子的物质的量为0.5mol |
| C.该反应中的氧化剂为KNO3 |
| D.被氧化和被还原的N原子的物质的量之比为15:1 |
将0.195g锌粉加入到20.0mL的0.100 mol·L-1MO2+溶液中,恰好完全反应,则还原产物可能是
| A.M | B.M2+ | C.M3+ | D.MO2+ |
工业制ClO2的化学反应:2NaClO3+SO2+H2SO4=2ClO2+2NaHSO4,下列说法正确的是
| A.NaClO3在反应中化合价降低,失去电子 |
| B.SO2在反应中发生氧化反应 |
| C.1mol氧化剂在反应中得到2mol电子 |
| D.H2SO4 在反应中作氧化剂 |
下列过程中涉及化学变化,且属于氧化还原反应的是
| A.家庭中经常用食醋浸泡有水垢的水壶 |
| B.甘油加水作护肤剂 |
| C.烹鱼时,加入少量的酒和食醋可减少腥味,增加香味 |
| D.交通警察用酸性重铬酸钾检查司机是否酒后驾车 |