题目内容
9.下列关于物质的用途,不正确的( )| A. | 小苏打可用于治疗胃酸过多 | B. | Cl2可与石灰乳反应制取漂白粉 | ||
| C. | 用苯可萃取溴水中的溴 | D. | 高纯硅用来制造光导纤维 |
分析 A、根据小苏打的化学式为NaHCO3,它的水溶液呈碱性,胃酸的主要成分为盐酸分析;
B、氯气和石灰乳氢氧化钙反应是工业制备漂白粉的制备方法;
C、苯不溶于水,在水溶液中分层,溴单质溶解性在苯中溶解度大;
D、高纯硅制备太阳能电池板,光导纤维是二氧化硅;
解答 解:A、小苏打是碳酸氢钠的俗称,胃酸主要是盐酸,二者反应生成氯化钠、水和二氧化碳,并且小苏打无毒、无害,故A正确;
B、氯气和石灰乳氢氧化钙反应是工业制备漂白粉,Cl2可与石灰乳反应制取漂白粉,故B正确;
C、苯不溶于水,在水溶液中分层,溴单质溶解性在苯中溶解度大,萃取分液分离,用苯可萃取溴水中的溴,故C正确;
D、高纯硅制备太阳能电池板,光导纤维是二氧化硅,故D错误;
故选D.
点评 本题考查了物质性质和用途的分析判断,掌握基础,理解性质应用是解题关键,题目较简单.

练习册系列答案
 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目
20.下列烧杯中盛放的都是稀硫酸,不能构成原电池的是( )
| A. | 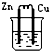 | B. | 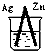 | C. | 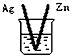 | D. | 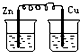 |
17.下列各组物质中的两种,互为同系物的是( )
| A. | O2和03 | B. | CH4和C3H8 | C. | 正丁烷和异丁烷 | D. | C2H4和C3H6 |
14.对于反应CaH2+2H2O═Ca(OH)2+2H2↑,有下列判断:①H2只是氧化产物;②H2只是还原产物;③H2O是氧化剂;④CaH2中的氢元素被还原;⑤此反应中氧化产物与还原产物的原子个数之比是1:1,
上述判断中正确的是( )
上述判断中正确的是( )
| A. | ①②③ | B. | ③⑤ | C. | ②④ | D. | ④⑤ |
1.短周期元素X,Y,Z,W,Q在元素周期表中的相对位置如图所示.下列说法正确的是( )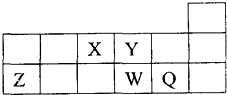

| A. | 离子Y2一和Z3+的核外电子数和核内质子数都相同 | |
| B. | 原子半径的大小顺序为:r(Z)>r(W)>r(Q)>r(Y)>r(X) | |
| C. | 最高价氧化物对应的水化物的酸性:W>Q | |
| D. | 元素X与元素Z的最高正化合价数值之和等于8 |
18.一定温度时,在容积一定的密闭容器中通人一定量的HI气体,使其在一定条件下发生反应:2HI(g)?H2(g)+I2(g),下列叙述中一定表示达到化学平衡状态的是( )
| A. | HI、H2、I2的浓度相等且不再改变时 | B. | 混合气体的颜色深浅不再变化时 | ||
| C. | 混合气体的平均摩尔质量不变时 | D. | v(HI):v(H2):v(I2)=2:1:1时 |
19.矿石中金的含量很低,金的性质又相当稳定,只能用湿法冶金-氰化法提炼,即采用稀的NaOH溶液处理已粉碎的矿石,把少量的金浸取入溶液中,后用金属锌作还原剂将金从溶液中置换析出,其反应原理为:
①4Au+8NaCN+O2+2H2O═4Na[Au(CN)2]+4NaOH
②2Na[Au(CN)2]+Zn═2Au+Na2[An(CN)4]
以下有关氰化法提炼金的说法中正确的是( )
①4Au+8NaCN+O2+2H2O═4Na[Au(CN)2]+4NaOH
②2Na[Au(CN)2]+Zn═2Au+Na2[An(CN)4]
以下有关氰化法提炼金的说法中正确的是( )
| A. | Na[Au(CN)2]可溶于水 | |
| B. | 化合物Na[Au(CN)2]中金元素的化合价为+2 | |
| C. | 金化学性质稳定,不与任何物质反应 | |
| D. | 在提炼过程中含金元素的物质始终作氧化剂 |