题目内容
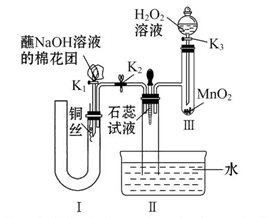
(20分)某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明Cl2的某些性质,甲同学设计了如图所示的实验装置(支撑用的铁架台省略),按要求回答问题:
(1)下列方法中,可制得的正确组合是__________。
①MnO2和浓盐酸混合共热; ②MnO2、NaCl和浓硫酸混合共热:
③NaClO和浓盐酸混合; ④K2Cr2O7和浓盐酸混合:
⑤KClO3和浓盐酸混合共热; ⑥KMnO4和浓盐酸混合。
A.①②⑥B.②④⑥C.①④⑥ D.全部可以
(2)写出实验室制取Cl2的离子方程式____________。
(3)若用含有0.2 mol HCl的浓盐酸与足量的MnO2反应制得Cl2的体积(标况下)总是小于1.12L的原因是_________________________________________。
(4)①装置B的作用是__________________________________。
②装置C和D出现的不同现象说明的问题是________________________。
③装置E的作用是_____________________。
(5)乙同学认为甲同学的实验有缺陷,不能确像最终通入AgNO3溶液中的气体只有一种。为了确保实验结论的可靠性,证明最终通入AgNO3溶液中的气体只有一种,乙同学提出应该在装置__________与________之间(填装置字母序号)增加一个装置,增加装置里面的试剂可为____________。
A.湿润的淀粉KI试纸B.氢氧化钠溶液
C.湿润的红色布条 D.饱和的食盐水
(20分)
(1)D(2分)
(2)4H++2Cl-+MnO2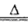 2H2O + Cl2↑+Mn2+;(3分)
2H2O + Cl2↑+Mn2+;(3分)
(3)随着反应的进行,盐酸浓度变稀将不再反应(3分,其他合理答案也给分)
(4)①证明有水蒸气产生,并吸收水蒸气,避免对后面探究氯气的性质实验产生干扰;(3分)
②氯气无漂白性,次氯酸有漂白性(3分)
③吸收氯气(2分)
(5)E,F;(2分) AC(2分)
解析试题分析:(1)制取氯气的方法由多种,但共同点有1个,都是浓盐酸作还原剂,所以合适的氧化剂与浓盐酸反应可以制取氯气,题目所给方法都可以,答案选D;
(2)实验室制取氯气采用MnO2和浓盐酸混合共热的方法,离子方程式为4H++2Cl-+MnO2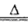 2H2O + Cl2↑+Mn2+;
2H2O + Cl2↑+Mn2+;
(3)二氧化锰与稀盐酸不反应,所以随着反应的进行,盐酸浓度变稀,反应停止,制得Cl2的体积(标况下)总是小于1.12L;
(4)①用无水硫酸铜来检验是否有水产生,若有,则固体颜色由白色变为蓝色,后面的实验要求氯气使干燥的,所以装置B同时还可以吸收水蒸气,避免对后面探究氯气的性质实验产生干扰;
②干燥的有色布条不褪色说明氯气不具有漂白性,湿润的有色布条褪色,说明氯气与水反应产生的次氯酸具有漂白性;
③氯气在水中的溶解度不大,但在有机溶剂中的溶解度较大,所以装置E的作用是吸收多余的氯气;
(5)装置E吸收氯气,但不能证明氯气是否被吸收干净,所以在E、F间应加一个装置,用来检验氯气是否除尽,从而判断通入AgNO3溶液中的气体是否只有一种;检验氯气是否除尽的试剂可以是湿润的淀粉KI试纸,若试纸变蓝,说明氯气未除尽;还可以是湿润的红色布条,若布条褪色,说明氯气未除尽,反之则除尽,答案选AC。
考点:考查对制取氯气方法的判断,离子方程式的书写,试剂的选择,装置作用的判断及选择

 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案(14分)
研究小组用下图装置制取Cl2,证明产生的气体中含有HCl。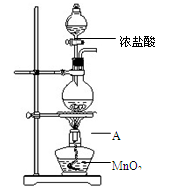
(1)仪器A的名称为 ;A中反应的离子方程式为 。
(2)甲同学将A中产生的气体通入下列溶液:
| 实验序号 | 试剂 | 现象 |
| a | 紫色石蕊溶液 | |
| b | AgNO3溶液 | 出现白色沉淀 |
②不能证明产生的气体中含有HCl的实验是 (填字母序号)。
(3)已知将HCl气体通入饱和食盐水中有白色固体析出。乙同学将A中产生的气体通入饱和食盐水中,有白色固体析出,但该实验不能证明气体中含有HCl,结合化学用语解释其原因: 。
(4)已知:2S2O32- + I2 ="==" S4O62- + 2I-。丙同学将A中产生的气体通入蒸馏水中,得到溶液X,进行以下实验证明气体中含有HCl。
I.测定X中溶解的Cl2。取25.00 mL溶液X,加入过量KI溶液,然后用0.04 mol?L-1 Na2S2O3溶液滴定生成的I2,达滴定终点时消耗Na2S2O3溶液V mL。
II.测定X中Cl元素总量。另取25.00 mL溶液X,选用适当的还原剂将溶解的Cl2全部还原为Cl-,再用0.10 mol?L-1 AgNO3溶液滴定所得溶液中的Cl-。
X中的HClO不会影响I的测定结果,原因是 。
由I、II 中实验数据可证明A中产生的气体中含有HCl,则II中消耗0.10 mol?L-1 AgNO3溶液的体积应大于 mL(用含V的代数式表示)。
某兴趣小组设计出下图所示装置来改进教材中“铜与硝酸反应”实验,以探究化学实验的绿色化。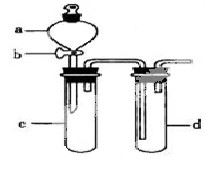
(1)实验前,关闭活塞b,试管d中加水至浸没长导管口,塞紧试管c和d的胶塞,加热c,其目的是__________。
(2)在d中加适量NaOH溶液,c中放一小块铜片,由分液漏斗a向c中加入2mL浓硝酸,c中反应的化学方程式是______________________。
再由a向c中加2mL蒸馏水,c中的实验现象是_____________。
(3)下表是制取硝酸铜的三种方案,能体现绿色化学理念的最佳方案是_____,理由是_______。
| 方案 | 反应物 |
| 甲 | Cu、浓硝酸 |
| 乙 | Cu、稀硝酸 |
| 丙 | Cu、O2、稀硝酸 |