��Ŀ����
����Ŀ��ij��ȤС����С����ý������ᷴӦ����ʵ�飬��5.4g����ƬͶ��500mL 0.5molL��1��������Һ�У���ͼΪ��Ӧ�������������뷴Ӧʱ��Ĺ�ϵͼ�� 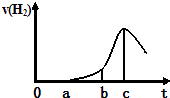
��1�����й���ͼ���˵������ȷ����������ţ���ͬ���� ��a��b�β���H2�ӿ�����DZ��������Ĥ���ܽ⣬�ӿ��˷�Ӧ����
��b��c�β���H2�Ͽ�����Ǹ÷�Ӧ���ȣ������¶����ߣ��ӿ��˷�Ӧ
��c�Ժ���H2�������½���������Ƭ����������ȫ
��2�������������䣬�ֻ���500mL 1molL��1���ᣬ�������������ձ��ʹ��500mL 0.5molL��1����Ŀ죬���ܵ�ԭ������ ��������c��H+����Ũ�ȸ��� ��Cl���д����� ��SO42���д�����
��SO42�����軯���ã�ʹ��Ӧ������ ��Al3+�д�����
��3��Ҫ�ӿ�����������Һ��H2�ķ�Ӧ���ʣ�С���Ա���һϵ�з��������磺�ټ���ij�ִ������ڼ�������ˮ���۽���Ƭ�������ۣ������������Ũ����18mol/L�������� �� ���Ϸ��������������������ٲ������ֺ�������������հעݢ���
���𰸡�
��1����
��2���ڢ�
��3�������¶ȣ���������CuSO4��Һ���ڢ�
���������⣺��1��5.4gAl�����ʵ���Ϊ��0.2mol��500mL 0.5molL��1��������Һ�к���������ʵ���Ϊ��0.5mol/L��0.5L=0.25mol��Al���������ᷴӦ��ȫ��������a��b�β���H2�ӿ�����DZ��������Ĥ���ܽ⣬�ӿ��˷�Ӧ���ʣ��ʢ���ȷ����������b��c�Σ������������������ӽϿ����Ҫԭ��Ϊ�÷�ӦΪ���ȷ�Ӧ���¶����ߣ���Ӧ���ʼӿ죬�ʢ���ȷ����������c�Ժ����������������½�����Ҫԭ��Ϊ������Ũ�ȼ�С����Ӧ���ʼ�С���ʢ۴������Դ��ǣ��ۣ���2�������������䣬�ֻ���500mL 1molL��1���ᣬ�������������ձ��ʹ��500mL 0.5molL��1����Ŀ죬ֻ�������������˴����û�SO42�����軯���ã�ʹ��Ӧ�����������Դ��ǣ��ڢܣ���3���ټ���ij�ִ������ӿ췴Ӧ���ʣ� �ڼ�������ˮ��ϡ����Һ����Ӧ���ʼ������۽���Ƭ�������ۣ�����Ӧ��ĽӴ��������Ӧ�����������������Ũ����18mol/L�������ۻ��������ӿ�����������Һ��H2�ķ�Ӧ�����������¶ȣ���������CuSO4��Һ���γ�ԭ��صȣ� ���Դ��ǣ������¶ȣ���������CuSO4��Һ���ڢܣ�

 �����ߴ���ϵ�д�
�����ߴ���ϵ�д�