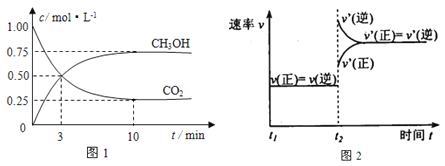
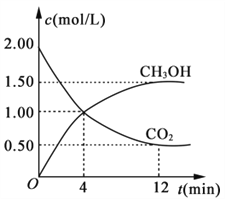
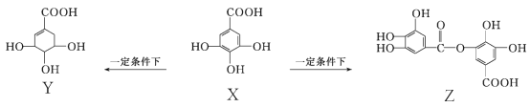
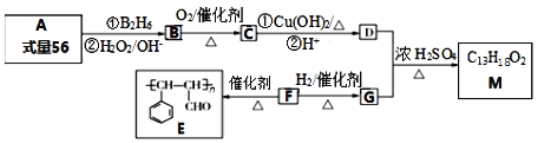
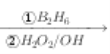题目内容
【题目】用下列装置(夹持仪器已略去)进行相关实验,装置正确且能达到实验目的的是( )
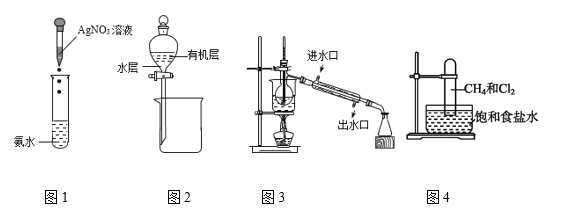
A. 图1装置配制银氨溶液
B. 图2装置分离苯萃取碘水后已分层的水层与有机层
C. 图3装置进行石油的分馏
D. 图4装置CH4和Cl2完全反应后液面上升,液体充满试管
【答案】B
【解析】
A.配制银氨溶液的方法为向硝酸银溶液中滴加氨水,滴加氨水至生成的沉淀恰好溶解即可,故A不选;
B.苯萃取碘水后,苯的密度小于水,有机层位于上层,水层在下层,通过分液方法分离,可以达到实验目的,故B选;
C.分馏时,温度计的水银球应该位于蒸馏烧瓶的支管口处,冷却水应该“下口进、上口出”,故C不选;
D.甲烷与氯气发生取代反应后生成的一氯甲烷为气体,其它有机产物均为液体,且生成的HCl易溶于水,因此甲烷和氯气的反应为气体的物质的量减少的反应,故会导致反应后液面上升,但液体不能充满整个试管,故D不选。
故选B。

 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案【题目】I:电离平衡常数是衡量弱电解质电离程度的量。已知如下表数据(25 ℃):
化学式 | 电离平衡常数 |
HCN | K=4.9×10-10 |
CH3COOH | K=1.8×10-5 |
H2CO3 | K1=4.4×10-7,K2=4.7×10-11 |
(1)25 ℃时,等浓度的三种溶液(A.NaCN溶液、B.Na2CO3溶液、C.CH3COONa溶液)的pH由大到小的顺序为______(填写序号)
(2)25℃时,向NaCN溶液中通入少量CO2,所发生反应的离子方程式为__________;
(3)现有浓度为0.02 mol/L的HCN与0.01mol/L NaOH等体积混合后,测得c(Na+)>c(CN-),下列关系正确的是____(填标号)。
A.c(H+)>c(OH-) B.c(H+)<c(OH-)
C.c(H+)+c(HCN) = c(OH-) D.c(HCN)+ c(CN-)=0.01mol/L
(4)已知NaHCO3溶液呈碱性,原因是____(用离子方程式表示);请写出该溶液中各离子浓度的大小_____________,电荷守恒表达式_________;
II:按要求填空:
(1)在配制氯化铁溶液时,为了防止发生水解,可以加入少量的____________。
(2)浓的Al2(SO4)3溶液和浓的小苏打(NaHCO3)溶液混合可用于灭火,请用离子反应方程式表示灭火的原理_______;
(3)将25℃下pH=12的NaOH溶液aL与pH=1的HCl溶液b L混合,若所得混合液为中性,则a:b=_____。(溶液体积变化忽略不计)。