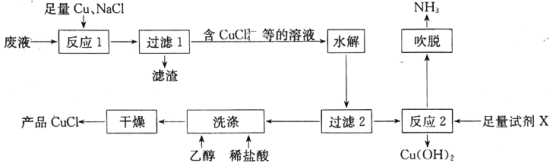
题目内容
【题目】室温下,向10 mL 0.10molL1-1YOH溶液中逐渐滴加0.20molL-1HX 溶液,混合溶液的pH 变化如图所示(温度和体积变化忽硌不计)。下列结论错误的是
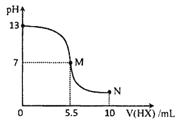
A.HX为一元弱酸,YOH 为一元强碱
B.M点对应溶液中水的电离程度大于N 点溶液中水的电离程度
C.N点对应溶液中粒子浓度:c(HX)> c(X - ) > c(Y+ ) > c(H+ ) > c(OH-)
D.室温时,pH = a 的YX溶液中水电离出的c(OH-)=l.0×10-(14-a)molL-1
【答案】C
【解析】
A.由图可知0.10molL1-1YOH溶液pH=13,该碱溶液中c(OH-)=c(YOH)=0.1mol/L,说明YOH完全电离,则YOH为强碱;滴加0.20molL-1HX溶液5mL时恰好完全反应,生成正盐YX,此时溶液pH>7,说明X-水解,则HX为弱酸,故A正确;
B.M和N点均存在X-的水解,但过量的HX电离出的H+抑制了水的电离,且过量HX越多,对水的电离抑制能力越大,则M点对应溶液中水的电离程度大于N 点溶液中水的电离程度,故B正确;
C.N点溶液中溶质为YX和HX,且两者浓度相等,此时溶液显酸性,说明HX的电离程度大于X-的水解程度,则c(X - ) > c(Y+ ) >c(HX)> c(H+ ) > c(OH-),故C错误;
D.X-的水解促进水的电离,YX溶液中c(OH-)来自水的电离,则室温时,pH = a 的YX溶液中水电离出的c(OH-)=l.0×10-(14-a)molL-1,故D正确;
故答案为C。

 口算小状元口算速算天天练系列答案
口算小状元口算速算天天练系列答案 天天练口算系列答案
天天练口算系列答案【题目】Ⅰ.已知某可逆反应:aA(g)+bB(g) ![]() cC(g)+dD(g)。请回答下列问题:
cC(g)+dD(g)。请回答下列问题:
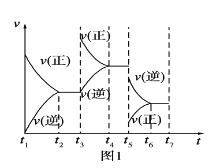
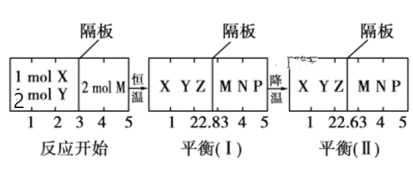
(1)根据实验测定结果,描绘出了该反应达到平衡状态时及改变外界条件后,反应速率与时间的关系图像(如图1所示),有利于提高D产量的变化过程是图像中的______段;引起该变化过程的外界条件是_________________________________________。
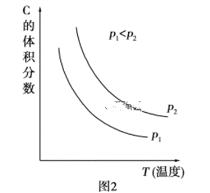
(2)根据实验测定结果描绘出了图2。由此图像可以得出,升高温度,上述平衡将向____(填“正反应”或“逆反应”)方向移动;反应计量数之间的关系:a+b______c+d(填“大于”、“小于”、“等于”或“不确定”)。
Ⅱ.工业合成氨反应如下:N2+3H2![]() 2NH3。请回答下列问题:
2NH3。请回答下列问题:
(1)在一定条件下2L的密闭容器中进行实验,并测得下列数据:
物质 | N2 | H2 | NH3 |
起始(mol) | 2 | 7 | 0 |
10s(mol) | 1.6 | ||
平衡时(mol) | 2 |
则10s内,用氢气表示的化学反应速率是______,该反应的化学平衡常数是________。
(2)根据混合气体各成分的物质性质,你认为工业上将氨气从混合气体中分离出来的措施是________,从而达到反应气体循环利用的目的。实验室检验氨气的方法是__________。