题目内容
氮元素可以形成多种化合物.回答以下问题:
(1)基态氮原子的价电子排布式是
(2)C、N、O三种元素第一电离能从大到小的顺序是
(3)肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物.NH3分子的空间构型是
(1)基态氮原子的价电子排布式是
2s22p3
2s22p3
.(2)C、N、O三种元素第一电离能从大到小的顺序是
N>O>C
N>O>C
.(3)肼(N2H4)分子可视为NH3分子中的一个氢原子被-NH2(氨基)取代形成的另一种氮的氢化物.NH3分子的空间构型是
三角锥形
三角锥形
;N2H4分子中氮原子轨道的杂化类型是sp3
sp3
.分析:(1)N原子核外有7个电子,最外层有5个电子,根据构造原理顺序其价电子排布式;
(2)同一周期元素的第一电离能随着原子序数的增大而呈增大的趋势,但第IIA族和第VA族元素的第一电离能大于相邻元素;
(3)根据价层电子对互斥理论确定分子空间构型和原子的杂化方式.
(2)同一周期元素的第一电离能随着原子序数的增大而呈增大的趋势,但第IIA族和第VA族元素的第一电离能大于相邻元素;
(3)根据价层电子对互斥理论确定分子空间构型和原子的杂化方式.
解答:解:(1)氮原子的电子排布式1s22s22p3,其价层电子排布式为2s22p3,故答案为:2s22p3;
(2)C、N、O属于同一周期元素且原子序数依次减小,同一周期元素的第一电离能随着原子序数的增大而增大,但第ⅤA族的大于第ⅥA族的,所以其第一电离能大小顺序是N>O>C,故答案为:N>O>C;
(3)NH3分子中氮原子含有3个共价键和一个孤电子对,所以空间构型是三角锥型;N2H4分子中氮原子的加成电子对=3+1=4,含有一个孤电子对,N原子轨道的杂化类型是sp3,故答案为:三角锥型;sp3.
(2)C、N、O属于同一周期元素且原子序数依次减小,同一周期元素的第一电离能随着原子序数的增大而增大,但第ⅤA族的大于第ⅥA族的,所以其第一电离能大小顺序是N>O>C,故答案为:N>O>C;
(3)NH3分子中氮原子含有3个共价键和一个孤电子对,所以空间构型是三角锥型;N2H4分子中氮原子的加成电子对=3+1=4,含有一个孤电子对,N原子轨道的杂化类型是sp3,故答案为:三角锥型;sp3.
点评:本题考查了分子空间构型的判断、原子的杂化方式的判断等知识点,难度不大,注意分子空间构型的判断及原子杂化方式的判断是高考的热点.

练习册系列答案
相关题目
 氮元素可以形成多种化合物.
氮元素可以形成多种化合物.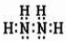
 I:氮元素可以形成多种化合物.回答以下问题:
I:氮元素可以形成多种化合物.回答以下问题: