题目内容
有一硫酸和硝酸的混合溶液,取出其中的10mL,加入足量 BaCl2溶液,将生成的沉淀滤出洗净,烘干称得其质量为9.32g;另取此溶液10mL与4.00 mol·L-1的NaOH溶液25mL恰好完全中和。求:
①混合液中硫酸的物质的量浓度是多少?
②混合液中硝酸的物质的量浓度又是多少?
③若将9.6g铜片投入到10mL的混合溶液中,则标况下能生成气体多少毫升?
①混合液中硫酸的物质的量浓度是多少?
②混合液中硝酸的物质的量浓度又是多少?
③若将9.6g铜片投入到10mL的混合溶液中,则标况下能生成气体多少毫升?
(1)混酸中只有硫酸和氯化钡反应生成沉淀,反应式为
H2SO4+BaCl2=2HCl+BaSO4↓
1mol 233g
cV 9.32g
所以有
(2)强酸和氢氧化钠反应的离子方程式为H++OH-=H2O。恰好反应。说明氢离子的物质的量和OH-的物质的量相等,所以有4.0mol/L×0.01L×2+c(HNO3)×0.01L=4.0mol/L×0.025L,解得c(HNO3)=2.0mol/L。
(3)9.6g铜是 ,10mL的混合溶液中硫酸是0.04mol,硝酸是0.02mol,所以氢离子的物质的量是0.1mol。硝酸和铜反应的离子方程式为
,10mL的混合溶液中硫酸是0.04mol,硝酸是0.02mol,所以氢离子的物质的量是0.1mol。硝酸和铜反应的离子方程式为
3Cu + 8H+ + 2NO3-=3Cu2++4H2O+2NO↑
3mol 8mol 2mol 2mol
0.15mol 0.1mol 0.02mol
所以铜和氢离子是过量的,NO3-是不足的,即NO3-被完全还原生成NO,所以NO的物质的量是0.02mol,其标准状况下的体积是0.02mol×22.4L/mol=0.448L。
H2SO4+BaCl2=2HCl+BaSO4↓
1mol 233g
cV 9.32g
所以有

(2)强酸和氢氧化钠反应的离子方程式为H++OH-=H2O。恰好反应。说明氢离子的物质的量和OH-的物质的量相等,所以有4.0mol/L×0.01L×2+c(HNO3)×0.01L=4.0mol/L×0.025L,解得c(HNO3)=2.0mol/L。
(3)9.6g铜是
 ,10mL的混合溶液中硫酸是0.04mol,硝酸是0.02mol,所以氢离子的物质的量是0.1mol。硝酸和铜反应的离子方程式为
,10mL的混合溶液中硫酸是0.04mol,硝酸是0.02mol,所以氢离子的物质的量是0.1mol。硝酸和铜反应的离子方程式为3Cu + 8H+ + 2NO3-=3Cu2++4H2O+2NO↑
3mol 8mol 2mol 2mol
0.15mol 0.1mol 0.02mol
所以铜和氢离子是过量的,NO3-是不足的,即NO3-被完全还原生成NO,所以NO的物质的量是0.02mol,其标准状况下的体积是0.02mol×22.4L/mol=0.448L。
考查根据化学方程式进行的有关计算。这种类型的计算,关键是弄清楚发生的反应,并正确写出有关的化学反应方程式,然后根据条件列式进行计算即可。如果反应物的量都是已知的还要判断过量。因为硫酸和铜不反应,但可以提供氢离子,所以只要氢离子足量,硝酸就有可能被完全还原,所以在判断过量时要用离子方程式进行判断。

练习册系列答案
 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案
相关题目
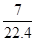 NA
NA