题目内容
某工厂排放的工业废水中含Fe3+、A13+、Cu2+,工厂为了减少环境污染,变废为宝,利用废铁屑和其它化学试剂进行如下操作,得到了铁红、A12O3和金属Cu。
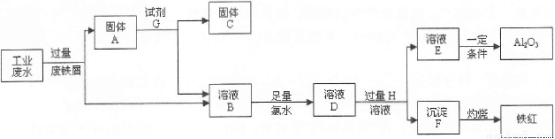
(1)固体A的成分是 。
(2)写出B→D的离子方程式 。
(3)溶液E焰色反应呈黄色,试剂H是 (填化学式)。
(4)写出D→F反应的离子方程式 。
(5)分别写出铁红和氧化铝在工业上的一种主要用途:铁红 ,氧化铝 。
(6)将溶液E转化为A12O3,请设计一个最合理的方案 (用文字表述)。
(1)Fe、Cu(共2分:答对1个给1分,答错一个不给分)
(2)2Fe2++Cl2=2Fe3++2Cl-(共2分)
(3)NaOH(共1分)
(4)Fe3++3OH-=Fe(OH)3↓(共2分)
(5)用作红色油漆和涂料 制造耐火坩埚等(共2分,答案合理即给分)
(6)在溶液E中通入过量的CO2,经过滤和洗涤后,加热固体即得Al2O3。(共1分;答到“加酸”给0.5分,答到“加热固体”给0.5分)
【解析】
试题分析:(1)Fe+2Fe3+=3Fe2+,Fe+Cu2+=Fe2++Cu,由于铁屑过量,则固体A由Fe、Cu组成;B溶液所含金属阳离子为Fe2+、A13+,固体C为目标产物之一的Cu;G为稀硫酸或稀盐酸;(2)氯水是强氧化剂,将Fe2+氧化为Fe3+,即2Fe2++Cl2=2Fe3++2Cl-;D溶液所含金属阳离子为Fe3+、A13+;(3)由目标产物逆推,E为NaAlO2溶液,F为Fe(OH)3,则H为NaOH;(4)Fe3+与OH—反应生成Fe(OH)3沉淀,即Fe3++3OH-=Fe(OH)3↓;(5)铁红常用作炼铁原料、红色油漆和涂料,氧化铝常用作炼铝原料、制造耐火坩埚等;(6)先将AlO2-转化为Al(OH)3沉淀,即AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-或3AlO2-+Al3++6H2O=4Al(OH)3↓;再过滤、洗涤,最后灼烧滤渣,使Al(OH)3分解生成Al2O3和H2O。
考点:考查钠铝铁铜等金属元素及其化合物、混合物的分离和提纯实验等相关知识。

 考前必练系列答案
考前必练系列答案