题目内容
【题目】我国秦俑彩绘和汉代器物上用的颜料被称为“中国蓝”、“中国紫”,直到近年来人们才研究出来其成分为BaCuSi4O10,BaCuSi2O6。
(1)“中国蓝”、“中国紫”中均具有Cun+离子,n=___,基态时该阳离子的价电子排布式为______。
(2)在5500年前,古代埃及人就己经知道如何合成蓝色颜料—“埃及蓝”CaCuSi4O10,其合成原料中用CaCO3代替了BaCO3,其它和“中国蓝”一致。CO32一中键角∠OCO为___。根据所学,从原料分解的角度判断“埃及蓝”的合成温度比“中国蓝”更___(填“高”或“低”)。
(3)配离子Cu(CN)32-中,中心离子的杂化类型是___________,该配离子的空间构型为___________;CN-中配位原子是___________ (填名称)。
(4)CaCux合金可看作由如图所示的(a)、(b)两种原子层交替堆积排列而成。(a)是由Cu和Ca共同组成的层,层中Cu—Cu之间由实线相连;(b)是完全由Cu原子组成的层,Cu—Cu之间也由实线相连。图中虚线构建的六边形,表示由这两种层平行堆积时垂直于层的相对位置;(c)是由(a)和(b)两种原子层交替堆积成CaCux合金的晶体结构图。在这种结构中,同一层的Ca—Cu距离为294pm,相邻两层的Ca—Cu距离为327pm。
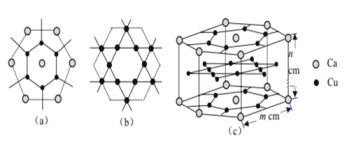
①该晶胞中Ca有___________个Cu原子配位(不一定要等距最近)。
②同一层中,Ca原子之间的最短距离是___________pm,设NA为阿伏加德罗常数的值,CaCu晶体的密度是___________g/cm3(用含m、n的式子表示)。
【答案】2 ![]()
![]() 低 sp2 平面三角形 碳 18
低 sp2 平面三角形 碳 18 ![]()
![]()
【解析】
(1)根据化学式BaCuSi4O10,BaCuSi2O6,其中Ba为+2价,Si为+4价,O为-2价,由化合价代数和为零得:“中国蓝”、“中国紫”中均具有Cun+离子,n=2,基态时该阳离子的价电子排布式为3d9。
故答案为:2;3d9;
(2)CO32一中心原子C的价电子为3+![]() =3,为平面三角形结构,键角∠OCO为120°。根据所学,钙离子半径小与氧之间的作用力大,碳酸钙更容易分解,故从原料分解的角度判断“埃及蓝”的合成温度比“中国蓝”更低。
=3,为平面三角形结构,键角∠OCO为120°。根据所学,钙离子半径小与氧之间的作用力大,碳酸钙更容易分解,故从原料分解的角度判断“埃及蓝”的合成温度比“中国蓝”更低。
故答案为:120°;低;
(3)配离子Cu(CN)32-中,中心离子的价层电子对个数是3且不含孤电子对,根据价层电子对互斥理论判断中心原子的杂化方式为sp2,该配离子的空间构型为平面三角形;CN-中配位原子是碳,因为N元素电负性较大,不易提供孤电子对,
故答案为: sp2 ;平面三角形;碳;
(4)①以上面面心上的Ca原子为例,该晶胞中该Ca原子配位的Cu原子包含其上面6个、相同层6个、下层6个,所以其配位数是18,
故答案为:18;
②同一层中,六边形中心上的Ca原子和边上的两个Ca原子形成正三角形,所以Ca原子之间的最短距离是六边形边长=2×![]() ×(同层相邻Ca-Cu距离)=2×
×(同层相邻Ca-Cu距离)=2×![]() ×294pm=294
×294pm=294![]() pm;
pm;
该晶胞中Ca原子个数=12×![]() +2×
+2×![]() =3、Cu原子个数=12×
=3、Cu原子个数=12×![]() +6×
+6×![]() +6=15,该晶胞体积=(
+6=15,该晶胞体积=(![]() m2sin60°×6×n)cm3=
m2sin60°×6×n)cm3=![]() m2ncm3,晶体密度=
m2ncm3,晶体密度= =
=![]() g·cm-3,
g·cm-3,
故答案为:![]() 。
。

 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案【题目】(1)已知反应2HI(g)=H2(g) + I2(g)的△H=+11kJ·mol-1,1molH2(g)、1molI2(g)分子中化学键断裂时分别需要吸收436KJ、151KJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为___kJ。
(2)已知某密闭容器中存在下列平衡:CO(g)+H2O(g) ![]() CO2(g)+H2(g),CO的平衡物质的量浓度c(CO)与温度T的关系如图所示。
CO2(g)+H2(g),CO的平衡物质的量浓度c(CO)与温度T的关系如图所示。

①该反应△H__________ 0(填“>”或“<”)
②若T1、T2时的平衡常数分别为K1、K2,则K1_______K2(填“>”、“<”或“=”)。
③T3时在某刚性容器中按1:2投入CO(g)和H2O(g),达到平衡后测得CO的转化率为75%,则T3时平衡常数K3=____________。
(3)在恒容密闭容器中,加入足量的MoS2和O2,仅发生反应: 2MoS2(s)+7O2(g) ![]() 2MoO3(s)+4SO2(g) ΔH。
2MoO3(s)+4SO2(g) ΔH。
测得氧气的平衡转化率与起始压强、温度的关系如图所示:

①p1、p2、p3的大小:_________。
②若初始时通入7.0 mol O2,p2为7.0 kPa,则A点平衡常数Kp=________(用气体平衡分压代替气体平衡浓度计算,分压=总压×气体的物质的量分数,写出计算式即可)。
(4)中科院兰州化学物理研究所用Fe3(CO)12/ZSM-5催化CO2加氢合成低碳烯烃反应,所得产物含CH4、C3H6、C4H8等副产物,反应过程如图。

催化剂中添加Na、K、Cu助剂后(助剂也起催化作用)可改变反应的选择性,在其他条件相同时,添加不同助剂,经过相同时间后测得CO2转化率和各产物的物质的量分数如下表。
助剂 | CO2转化率(%) | 各产物在所有产物中的占比(%) | ||
C2H4 | C3H6 | 其他 | ||
Na | 42.5 | 35.9 | 39.6 | 24.5 |
K | 27.2 | 75.6 | 22.8 | 1.6 |
Cu | 9.8 | 80.7 | 12.5 | 6.8 |
①欲提高单位时间内乙烯的产量,在Fe3(CO)12/ZSM-5中添加_______助剂效果最好;加入助剂能提高单位时间内乙烯产量的根本原因是_____;
②下列说法正确的是______;
a 第ⅰ步所反应为:CO2+H2![]() CO+H2O
CO+H2O
b 第ⅰ步反应的活化能低于第ⅱ步
c 催化剂助剂主要在低聚反应、异构化反应环节起作用
d Fe3(CO)12/ZSM-5使CO2加氢合成低碳烯烃的ΔH减小
e 添加不同助剂后,反应的平衡常数各不相同
【题目】下表是元素周期表的一部分,表中所列的字母分别代表一种化学元素。

试回答下列问题:
(1)h的单质在空气中燃烧发出耀眼的白光,请用原子结构的知识解释发光的原因:_____ 。
(2)o、p两种元素的部分电离能数据如下表所示:
元素 | o | p | |
电离能/ |
| 717 | 763 |
| 1509 | 1561 | |
| 3248 | 2957 | |
比较两元素的![]() 、
、![]() 可知,气态
可知,气态![]() 再失去一个电子比气态
再失去一个电子比气态![]() 再失去一个电子难。对此,你的解释是 ___________。
再失去一个电子难。对此,你的解释是 ___________。
(3)表中所列的某主族元素的电离能情况如图所示,则该元素是上述元素中的____(填元素符号)。


