题目内容
8.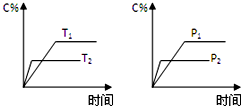 可逆反应aA(g)+bB(g)?cC(g)+dD(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图,下列叙述正确的是( )
可逆反应aA(g)+bB(g)?cC(g)+dD(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图,下列叙述正确的是( )| A. | 化学方程式中a+b>c+d | |
| B. | 达平衡后,加入催化剂则C%增大 | |
| C. | 达平衡后,若升温,平衡逆向移动 | |
| D. | 其他条件不变,在不同温度达平衡后,C在T1时的反应速率大于T2 |
分析 依据先拐先平数值大的原则,T2>T1,P2>P1,温度升高时,C的百分含量降低,说明升温平衡逆向移动,正反应放热,增大压强,C的百分含量降低,所以平衡逆向移动,据此分析.
解答 解:依据先拐先平数值大的原则,T2>T1,温度升高时,C的百分含量降低,说明升温平衡逆向移动,正反应放热,
A、P2>P1,增大压强,C的百分含量降低,所以平衡逆向移动,所以a+b<c+d,故A错误;
B、催化剂不影响平衡移动,故B错误;
C、正反应放热,升温平衡逆向移动,故C正确;
D、温度越高,反应速率越快,依据先拐先平数值大的原则,T2>T1,所以C在T1时的反应速率小于T2,故D错误;
故选C.
点评 本题考查了温度对化学平衡的影响,注意先拐先平数值大,题目难度不大.

练习册系列答案
 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案
相关题目
18.能够鉴别乙酸溶液、葡萄糖溶液、酒精溶液的试剂是( )
| A. | 稀盐酸 | B. | NaOH溶液 | C. | 新制Cu(OH)2悬浊液 | D. | Na2CO3溶液 |
19.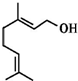 香叶醇是合成玫瑰香油的主要原料,其结构简式如图所示.下列有关香叶醇的叙述正确的是( )
香叶醇是合成玫瑰香油的主要原料,其结构简式如图所示.下列有关香叶醇的叙述正确的是( )
 香叶醇是合成玫瑰香油的主要原料,其结构简式如图所示.下列有关香叶醇的叙述正确的是( )
香叶醇是合成玫瑰香油的主要原料,其结构简式如图所示.下列有关香叶醇的叙述正确的是( )| A. | 不能使溴的四氯化碳溶液褪色 | B. | 香叶醇的分子式为C10H18O | ||
| C. | 不能使酸性高锰酸钾溶液褪色 | D. | 能发生取代反应和加成反应 |
3.某种“自热米饭”,在食用时,将某液体加入到某白色固体中,放上装有冷米饭和蔬菜的盒子,过几分钟米饭就热气腾腾,非常方便.试推测该液体和固体最有可能的组合是( )
| A. | 硝酸铵和水 | B. | 浓硫酸和水 | C. | 生石灰和水 | D. | 苛性钠和水 |
13.某有机物在氧气中充分燃烧,生成的CO2和H2O的物质的量之比为1:2,则( )
| A. | 分子中C、H、O个数之比为1:2:3 | B. | 分子中C、H个数之比为1:2 | ||
| C. | 分子中可能含有氧原子 | D. | 有机物的分子式为CH4Ox(x=O、1) |
18.与主族元素在元素周期表中所处的位置有关的是( )
| A. | 元素的相对原子质量 | B. | 原子的核内中子数 | ||
| C. | 原子的次外层电子数 | D. | 原子的电子层数和最外层电子数 |
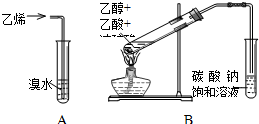 请回答下列问题:
请回答下列问题: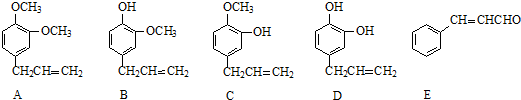
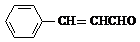 +2Ag(NH3)2OH$\stackrel{△}{→}$
+2Ag(NH3)2OH$\stackrel{△}{→}$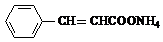 +H2O+2Ag↓+3NH3,Y的结构简式为
+H2O+2Ag↓+3NH3,Y的结构简式为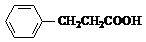 ,反应③属于加成反应.
,反应③属于加成反应.